Chọn đến phần học sinh cần nhanh chóng thông qua mục lục bằng cách click đến phần đó
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn
Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn 1 phương án.
(ghi chú: phải chỉ rõ mức độ biết, hiểu, vận dụng ở đầu mỗi câu)
Câu 1: (biết) Kí hiệu cặp oxi hoá – khử ứng với quá trình khử: $Fe^{3+} + 1e \rightarrow Fe^{2+}$ là
A. $Fe^{3+}/Fe^{2+}$
B. $Fe^{2+}/Fe$
C. $Fe^{3+}/Fe$
D. $Fe^{2+}/Fe^{3+}$
Câu 2: (biết) Trong số các ion: $Ag^+, Al^{3+}, Fe^{3+}, Cu^{2+}$, ion nào có tính oxi hoá mạnh nhất ở điều kiện chuẩn?
A. $Cu^{2+}$
B. $Fe^{3+}$
C. $Ag^+$
D. $Al^{3+}$
Câu 3: (biết) Trong quá trình hoạt động của pin điện $Ni – Cu$, quá trình xảy ra ở anode là
A. $Cu \rightarrow Cu^{2+} + 2e^-$
B. $Ni \rightarrow Ni^{2+} + 2e$
C. $Cu^{2+} + 2e^- \rightarrow Cu$
D. $Ni^{2+} + 2e^- \rightarrow Ni$
Câu 4: (biết) Phương trình hoá học nào sau đây biểu diễn quá trình điều chế kim loại bằng phương pháp điện phân nóng chảy?
A. $CaCl_2 \rightarrow Ca + Cl_2$
B. $Fe_2O_3 + 3CO \rightarrow 2Fe + 3CO_2$
C. $Mg + CuSO_4 \rightarrow MgSO_4 + Cu$
D. $2NaCl + 2H_2O \rightarrow 2NaOH + H_2 + Cl_2$
Câu 5: (biết) Cho biết số thứ tự của Mg trong bảng tuần hoàn là 12. Vị trí của Mg trong bảng tuần hoàn là
A. chu kì 3, nhóm IIIA
B. chu kì 3, nhóm IIA
C. chu kì 3, nhóm IIB
D. chu kì 2, nhóm IIA
Câu 6: (biết) Những tính chất vật lí chung của kim loại (dẫn điện, dẫn nhiệt, dẻo, ánh kim) gây nên chủ yếu bởi
A. kiểu cấu tạo mạng tinh thể của kim loại
B. tính chất của kim loại
C. khối lượng riêng của kim loại
D. các electron tự do trong tinh thể kim loại
Câu 7: (biết) Nhờ có hàm lượng lớn trong vỏ Trái Đất nên một số kim loại được sử dụng làm kim loại cơ bản trong các hợp kim, đó là
A. sắt, nhôm và magnesium
B. sắt, kẽm và calcium
C. nhôm, magnesium và sodium
D. sắt, nhôm và thiếc
Câu 8: (biết) Kim loại X được sử dụng trong nhiệt kế, áp kế và một số thiết bị khác. Ở điều kiện thường, X là chất lỏng. Kim loại X là
A. W
B. Cr
C. Hg
D. Pb
Câu 9: (biết) Dãy gồm các kim loại đều phản ứng với nước ở nhiệt độ thường tạo thành dung dịch có môi trường kiềm là
A. Na, Fe, K
B. Na, Cr, K
C. Mg, Na, Ca
D. Na, Ba, K
Câu 10: (biết) Nhóm những kim loại có độ dẫn điện tốt nhất là
A. Cu, Al, Hg
B. Ag, Cu, Au
C. Li, Na, K
D. Fe, Cu, Zn
Câu 11: (biết) Nguyên tắc tách kim loại là
A. khử ion kim loại thành đơn chất
B. oxi hoá ion kim loại thành nguyên tử
C. khử nguyên tử kim loại thành ion
D. oxi hoá nguyên tử kim loại thành ion
Câu 12: (biết) Nhúng thành kim loại Zn vào dung dịch chất nào sau đây thì xảy ra hiện tượng ăn mòn điện hoá?
A. KCl
B. HCl
C. $CuSO_4$
D. $MgCl_2$
Câu 13: (biết) Duralumin là hợp kim của nhôm có thành phần chính là
A. nhôm và sắt
B. nhôm và thủy ngân
C. nhôm và carbon
D. nhôm và đồng
Câu 14: (hiểu) Xét quá trình điện phân dung dịch NaCl 20% bằng dòng điện một chiều (với điện cực trơ, có màng ngăn xốp). Quá trình khử xảy ra ở cathode là
A. $Cl_2 + 2e^- \rightarrow 2Cl^-$
B. $2H_2O + 2e \rightarrow H_2 + 2OH^-$
C. $2Cl^- \rightarrow Cl_2 + 2e^-$
D. $H_2O \rightarrow 2H^+ + \frac{1}{2}O_2 + 2e^-$
Câu 15: (vận dụng) Cho các pin điện hoá và sức điện động chuẩn tương ứng: (X, Y, Z là ba kim loại.)
| Pin điện hoá | Cu – X | Y – Cu | Z – Cu |
|---|---|---|---|
| Sức điện động chuẩn (V) | 0,46 | 1,1 | 1,47 |
Dãy các kim loại xếp theo chiều tăng dần tính khử từ trái sang phải là
A. X, Cu, Z, Y
B. Y, Z, Cu, X
C. Z, Y, Cu, X
D. X, Cu, Y, Z
Câu 16: (vận dụng) Cho một thanh Fe tiếp xúc với một thanh Cu, sau đó nhúng vào dung dịch HCl, hiện tượng sẽ quan sát được là
A. thanh Fe tan và bọt khí chỉ thoát ra từ thanh Cu.
B. cả 2 thanh tan đồng thời và khí thoát ra từ 2 thanh.
C. thanh Fe tan trước và bọt khí thoát ra trên thanh Fe.
D. thanh Fe tan và bọt khí thoát ra từ cả thanh Fe và thanh Cu.
Câu 17: (vận dụng) Thực hiện các thí nghiệm sau:
(1) Nhúng sợi dây bạc trong dung dịch $HNO_3$.
(2) Đốt dây nhôm trong không khí.
(3) Lấy sợi dây đồng quấn quanh đinh sắt rồi nhúng vào dung dịch HCl.
(4) Nhúng thanh kẽm trong dung dịch $CuSO_4$.
Số trường hợp xuất hiện ăn mòn điện hoá là
A. 3.
B. 2.
C. 4.
D. 5.
Câu 18: (vận dụng) Nguyên nhân chủ yếu làm cho hợp kim cứng hơn các kim loại thành phần là do
A. hợp kim chứa các kim loại pha trộn cứng hơn kim loại cơ bản.
B. trong hợp kim, các nguyên tố khác nhau tạo nên hợp chất hoá học.
C. hợp kim chứa các nguyên tử của các nguyên tố khác nhau làm cho các lớp tinh thể kim loại trong hợp kim khó trượt lên nhau.
D. hợp kim được chế tạo ở nhiệt độ cao làm cho hợp kim cứng hơn kim loại nguyên chất.
PHẦN II. Câu hỏi trắc nghiệm đúng sai.
Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu thí sinh chọn đúng hoặc sai.
(ghi chú: phải chỉ rõ mức độ biết, hiểu, vận dụng ở đầu mỗi ý trong mỗi câu)
Câu 19:
Xét quá trình hoạt động của một pin điện hoá Cu – Ag được thiết lập ở các điều kiện như hình vẽ bên.
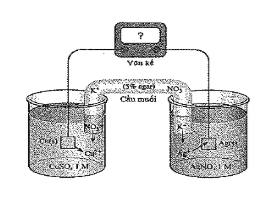
Cho thế điện cực chuẩn của các cặp $Cu^{2+}/Cu$ và $Ag^{+}/Ag$ lần lượt là +0,340 V và +0,799 V.
a) (biết) Phản ứng hoá học xảy ra trong pin: $Cu + 2Ag^{+} \to Cu^{2+} + 2Ag$
b) (hiểu) Điện cực Cu tăng khối lượng, điện cực Ag giảm khối lượng.
c) (hiểu) Ở anode xảy ra quá trình oxi hoá Cu, ở cathode xảy ra quá trình khử $Ag^{+}$.
d) (vận dụng) Giá trị sức điện động chuẩn của pin điện hoá trên là 0,549V.
Câu 20: Cho các phát biểu về vị trí, cấu tạo và tính chất của kim loại như sau:
a) (biết) Hầu hết các kim loại chỉ có từ 1 electron đến 3 electron lớp ngoài cùng.
b) (hiểu) Cho Mg vào lượng dư dung dịch $FeCl_3$ thì sau khi kết thúc phản ứng sẽ thu được kim loại.
c) (vận dụng) Cho luồng khí CO dư qua hỗn hợp các oxide CuO, $Fe_2O_3$, $Al_2O_3$, MgO nung nóng ở nhiệt độ cao. Sau phản ứng, hỗn hợp chất rắn thu được gồm Cu, FeO, $Al_2O_3$, MgO.
d) (vận dụng) Cho bột Fe vào dung dịch gồm $AgNO_3$ và $Cu(NO_3)_2$. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X gồm hai muối và chất rắn Y gồm hai kim loại là Ag và Cu.
Câu 21: Cho các phát biểu về phân tách, điều chế các kim loại như sau:
a) (biết) Phương pháp thích hợp để điều chế Mg từ $MgCl_2$ là điện phân dung dịch $MgCl_2$.
b) (hiểu) Trong phương pháp điện phân nóng chảy aluminium oxide, có thể thu được nhôm nóng chảy ở điện cực âm của bình điện phân.
c) (hiểu) Để làm tinh khiết một loại bột đồng có lẫn bột các kim loại thiếc, kẽm, chì, người ta cho hỗn hợp này vào dung dịch copper(II) nitrate dư.
d) (vận dụng) Dẫn khí CO dư qua ống sử dụng 16 gam $Fe_2O_3$ nung nóng, sau khi phản ứng xảy ra hoàn toàn thu được 11,2 gam kim loại.
Câu 22: Cho các phát biểu về hợp kim và ăn mòn kim loại như sau:
a) (hiểu) Hợp kim là hỗn hợp của một kim loại cơ bản và phi kim hoặc kim loại khác.
b) (hiểu) Nhúng thanh kim loại Zn vào dung dịch $CuSO_4$ thì xảy ra hiện tượng ăn mòn điện hoá.
c) (vận dụng) Để các hợp kim: Fe – Cu; Fe – C; Zn – Fe; Mg – Fe lâu ngày trong không khí ẩm. Có 3 hợp kim mà trong đó Fe bị ăn mòn điện hoá là Fe – Cu; Fe – C; Zn – Fe.
d) (vận dụng) Sắt tây là sắt (Fe) tráng thiếc (Sn). Trong trường hợp lớp thiếc bị xước sâu đến lớp sắt thì kim loại thiếc (Sn) sẽ bị ăn mòn trước.
PHẦN III. Câu trắc nghiệm yêu cầu trả lời ngắn.
Thí sinh trả lời từ câu 1 đến câu 6.
(ghi chú: phải chỉ rõ mức độ biết, hiểu, vận dụng ở đầu mỗi câu và đáp án ở mỗi câu là những con số có tối đa 4 kí tự theo quy ước làm tròn)
Câu 23: (hiểu) Tiến hành các thí nghiệm sau:
(1) Cho Zn vào dung dịch $AgNO_3$.
(2) Cho Fe vào dung dịch $Fe_2(SO_4)_3$.
(3) Cho Na vào dung dịch $CuSO_4$.
(4) Dẫn khí CO (dư) qua ống nghiệm có bột CuO, nung nóng.
Tổng số thí nghiệm tạo thành đơn chất kim loại sau phản ứng là
Câu 24: (hiểu) Hoà tan 23,4g hỗn hợp gồm Al, Fe, Cu bằng một lượng vừa đủ dung dịch $H_2SO_4$, thu được 16,73325 lít khí $SO_2$(đkc) và dung dịch chứa m gam muối. Giá trị của m là bao nhiêu?
Câu 25: (hiểu) Một pin điện hoá được thiết lập từ hai điện cực tạo bởi hai cặp oxi hoá – khử là $M^{2+}/M$ và $Ag^+/Ag$. Cho biết:
| Cặp oxi hoá – khử | $Fe^{2+}/Fe$ | $Ni^{2+}/Ni$ | $Sn^{2+}/Sn$ | $Cu^{2+}/Cu$ | $Ag^+/Ag$ |
|---|---|---|---|---|---|
| Thế điện cực chuẩn | -0,44 | -0,257 | -0,137 | +0,340 | +0,799 |
Nếu M là một trong số các kim loại: Fe, Ni, Sn, Cu thì sức điện động chuẩn lớn nhất của pin bằng bao nhiêu von? (Làm tròn kết quả đến phần trăm.)
Câu 26: (hiểu) Khi 100,0kg sắt lên gỉ sắt hoàn toàn thì tạo thành bao nhiêu kg gỉ sắt? (Giả thiết công thức hoá học
Câu 27: (vận dụng) Để mạ 5,0 gam bạc lên một đĩa sắt khi điện phân dung dịch chứa ion $[Ag(NH_3)_2]^+$ với dòng điện có cường độ $1,5 A$ không đổi cần thời gian t phút. Cho biết:
– Quá trình khử tại cathode: $[Ag(NH_3)_2]^+ + 1e \rightarrow Ag + 2NH_3$
– Điện lượng $q = I \cdot t = n_e \cdot F$, $F = 96500 C / mol$
Giá trị của t là bao nhiêu? (Làm tròn kết quả đến phần mười).
Câu 28: (vận dụng) Cho một pin Galvani với điện cực Zn và Cu có sức điện động chuẩn là $1,34 V$. Sử dụng pin này để thắp sáng một bóng đèn nhỏ với cường độ dòng điện chạy qua là $I = 0,02 A$. Nếu điện cực kẽm hao mòn $0,1 mol$ do pin phóng điện thì thời gian tối đa mà pin thắp sáng được bóng đèn là bao nhiêu giờ?
Cho biết các công thức: $Q = n \cdot F = I \cdot t$, trong đó: $Q$ là điện lượng $(C)$, n là số mol electron đi qua dây dẫn, I là cường độ dòng điện $(A)$, t là thời gian (giây), $F$ là hằng số Faraday ($96500 C \cdot mol^{-1}$).

ThS. Lê Thị Mai Nhi
(Người kiểm duyệt, ra đề)
Chức vụ: Trưởng ban biên soạn môn Hoá Học THPT
Trình độ: Thạc sĩ Hóa học, Chứng chỉ hạng II, Chứng chỉ STEM, Ngoại ngữ B1
Kinh nghiệm: 10+ năm kinh nghiệm tại Trường THPT Chuyên Nguyễn Huệ

