Chọn đến phần học sinh cần nhanh chóng thông qua mục lục bằng cách click đến phần đó
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn.
Thí sinh trả lời từ câu 1 đến câu 20. Mỗi câu hỏi thí sinh chỉ chọn 1 phương án.
Câu 1: Liên kết kim loại là liên kết được hình thành do
A. các electron tự do chuyển động quanh vị trí cân bằng giữa nguyên tử kim loại và ion dương kim loại ở các nút mạng.
B. sự cho và nhận electron giữa các nguyên tử kim loại.
C. sự góp chung electron giữa các nguyên tử kim loại.
D. lực hút tĩnh điện của ion dương kim loại này với nguyên tử kim loại.
Câu 2: Các tính chất vật lí chung của kim loại gây ra do
A. các electron tự do trong mạng tinh thể.
B. các ion kim loại.
C. các electron hóa trị.
D. Các kim loại đều là chất rắn.
Câu 3: Trong vỏ Trái Đất, những kim loại nào sau đây tồn tại chủ yếu dưới dạng đơn chất?
A. Ag, Au
B. Zn, Fe
C. Mg, Al
D. Na, Ba
Câu 4: Duralumin là hợp kim của nhôm có thành phần chính là
A. nhôm và đồng.
B. nhôm và sắt.
C. nhôm và cacbon.
D. nhôm và thủy ngân.
Câu 5: Theo chiều tăng dần của điện tích hạt nhân nguyên tử, sự biến đổi tính chất của các nguyên tố nhóm IA nào sau đây đúng?
A. Bán kính nguyên tử giảm dần.
B. Nhiệt độ nóng chảy tăng dần.
C. Độ cứng giảm dần.
D. Khối lượng riêng của đơn chất giảm dần.
Câu 6: Ở trạng thái cơ bản, nguyên tử K có cấu hình electron là $[Ar]4s^1$. Trong bảng tuần hoàn, nguyên tố K thuộc nhóm
A. IIIA.
B. IA.
C. IVA.
D. IIA.
Câu 7: Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của các kim loại nhóm IIA có dạng chung là
A. $ns^1$.
B. $ns^2$.
C. $ns^2np^1$.
D. $ns^2np^6$.
Câu 8: Nguyên tố calcium đóng vai trò thiết yếu cho việc phát triển xương, góp phần duy trì hoạt động của cơ bắp, truyền dẫn thần kinh, tăng cường khả năng miễn dịch. Trong cơ thể người, phần lớn calcium tập trung ở
A. xương.
B. răng.
C. cơ.
D. móng.
Câu 9: Hợp chất nào của calcium là thành phần hóa học chính của quặng apatite và phosphorite, được dùng trong công nghiệp sản xuất phân bón superphosphate?
A. $CaCO_3$
B. $Ca_3(PO_4)_2$
C. $Ca_3P_2$
D. $Ca(OH)_2$
Câu 10: Kim loại được mạ lên sắt để bảo vệ sắt và dùng để chế tạo thép không gỉ (dùng làm thìa, dao, dụng cụ y tế,…) là
A. Na.
B. Mg.
C. Cr.
D. Ca.
Câu 11: Sắt được sử dụng để sản xuất nam châm trong các máy phát điện và nhiều thiết bị điện (loa, chuông, tivi, máy tính, điện thoại,…) dựa trên tính chất nào sau đây?
A. Tính dẫn điện.
B. Tính dẫn nhiệt.
C. Tính dẻo.
D. Tính nhiễm từ.
Câu 12: Phát biểu nào sau đây không đúng?
A. Các nguyên tố kim loại chuyển tiếp đây thứ nhất thuộc khối d.
B. Zn là nguyên tử kim loại chuyển tiếp đây thứ nhất duy nhất có phân lớp 3d đã điền đầy electron.
C. Nguyên tử của các kim loại chuyển tiếp đây thứ nhất đều có lớp vỏ bên trong của khí hiếm Ar.
D. Kim loại chuyển tiếp đây thứ nhất thường tạo thành các hợp chất với nhiều số oxi hóa khác nhau.
Câu 13: Xét phức chất $[PtCl_2(NH_3)_4]^{2+}$ và $[FeF_6]^{3-}$. Phát biểu nào sau đây đúng?
A. Số lượng phối tử có trong mỗi phức chất lần lượt là 4 và 6.
B. Điện tích của mỗi phức chất lần lượt là +4 và +3.
C. Nguyên tử trung tâm trong mỗi phức chất là $Pt^{4+}$ và $Fe^{3+}$.
D. Cả 2 phức chất đều ít tan trong nước.
Câu 14: Với quá trình tách natri (sodium) bằng phương pháp điện phân sodium chloride nóng chảy, phát biểu nào sau đây là đúng?
A. Tại anode xảy ra quá trình khử ion $Na^+$.
B. Tại cathode xảy ra quá trình khử ion $Cl^-$
C. Tại cathode xảy ra quá trình khử ion $Na^+$.
D. Tại anode xảy ra quá trình khử ion $Cl^-$.
Câu 15: Phát biểu nào sau đây là sai?
A. Thông thường, kim loại M hoạt động càng mạnh thì giá trị thế điện cực chuẩn của cặp oxi hóa – khử $M^{n+}/M$ càng âm.
B. Kim loại M càng kém hoạt động thì giá trị thế điện cực chuẩn của cặp oxi hóa – khử $M^{n+}/M$ càng dương.
C. Trong cặp oxi hóa – khử $2H_2O/(H_2 + 2OH^-)$ thì $H_2O$ là dạng khử, $H_2$ là dạng oxi hóa.
D. Magnesium là kim loại có độ hoạt động hóa học mạnh hơn nhôm (aluminium), giá trị thế điện cực chuẩn của cặp $Mg^{2+}/Mg$ âm hơn giá trị thế điện cực chuẩn của cặp $Al^{3+}/Al$.
Câu 16: Cho một số phương pháp bảo vệ kim loại khỏi bị ăn mòn: (1) Cách li kim loại với môi trường xung quanh. (2) Dùng hợp kim chống gỉ. (3) Dùng chất kim hãm. (4) Ngâm kim loại trong $H_2O$. (5) Dùng phương pháp điện hóa. Các phương pháp đúng là
A. (1), (3), (4), (5).
B. (1), (2), (3), (4).
C. (2), (3), (4), (5).
D. (1), (2), (3), (5).
Câu 17: Thực hiện các sơ đồ phản ứng hóa học sau:
$X_1 + H_2O \xrightarrow{dpdd, nn} X_2 + X_3 ↑ + H_2 ↑$
$X_2 + X_4 \rightarrow BaCO_3 ↓ + Na_2CO_3 + H_2O$
$X_4 + X_5 \rightarrow BaSO_4 ↓ + K_2SO_4 + CO_2 ↑ + H_2O$
Nhận định nào sau đây đúng?
A. $X_2$ là KOH.
B. $X_5$ là $KHSO_4$.
C. $X_4$ là $NaHCO_3$.
D. $X_1$ là KCl.
Câu 18: Những phát biểu nào sau đây về phức chất bát diện $[Cu(OH_2)_6]^{2+}$ là đúng? (a) Nguyên tử trung tâm được hình thành từ quá trình cation $Cu^{2+}$ sử dụng 6 orbital trống để nhận các cặp electron hoá trị riêng của các phân tử $H_2O$ (b) Số oxi hóa của nguyên tử trung tâm là +2. (c) Số liên kết cho – nhận giữa phối tử và nguyên tử trung tâm cùng là hoá trị phối biến của đồng. (d) Mỗi phân tử nước chỉ sử dụng 1 trong 2 cặp electron hoá trị riêng của nó để tạo liên kết cho – nhận với cation $Cu^{2+}$
A. 2
B. 1
C. 4
D. 3
PHẦN II. Câu hỏi trắc nghiệm đúng sai.
Thí sinh trả lời từ câu 1 đến câu 3. Trong mỗi ý a), b), c), d) ở mỗi câu thí sinh chọn đúng hoặc sai.
Câu 1: Tiến hành thí nghiệm xác định hàm lượng iron(II) sulfate bằng phương pháp chuẩn độ thuốc tím trong môi trường sulfuric acid loãng, dự:
a) Thuốc tím phải cho vào burette, không được cho vào bình tam giác.
b) Cần sử dụng chất chỉ thị để nhận biết điểm kết thúc chuẩn độ.
c) Iron(II) sulfate là chất khử, thuốc tím là chất oxi hóa.
d) Phải đun nóng dung dịch trong bình tam giác trước khi chuẩn độ.
Câu 2: Thả một đinh sắt nặng $m_1$ gam đã được đánh sạch bề mặt vào cốc chứa dung dịch copper(II) sulfate màu xanh. Sau một thời gian thấy toàn bộ lượng đồng sinh ra đã bám vào “đinh sắt” (thực chất là phần đinh sắt chưa phản ứng). Lấy “đinh sắt” ra khỏi cốc dung dịch, sấy khô, đem cân được $m_2$ gam. Mỗi phát biểu sau đây là đúng hay sai?
(a) Phản ứng diễn ra là: $2Fe(s) + 3Cu^{2+}(aq) \rightarrow 2Fe^{3+}(aq) + 3Cu(s)$
(b) Màu xanh của dung dịch copper(II) sulfate nhạt dần.
(c) So sánh, thu được kết quả $m_2 < m_1$
(d) Nếu thay đinh sắt ban đầu bằng thanh kẽm thì màu xanh của dung dịch không thay đổi.
Câu 3: Phương pháp Solvay để sản xuất $Na_2CO_3$ trong công nghiệp được minh họa ở sơ đồ sau:
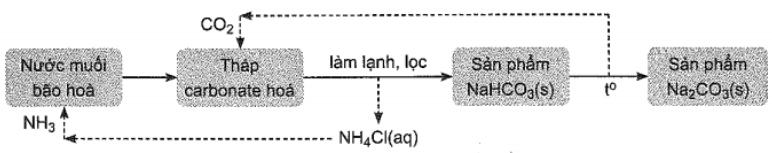
a) Ion hydrogencarbonate được tao thành tại tháp carbonate hóa.
b) Ở giai đoạn làm lạnh, $NaHCO_3$ được tách biệt bằng phương pháp kết tủa.
c) Phản ứng chuyển hóa $NaHCO_3$ thành $Na_2CO_3$ là phản ứng tỏa nhiệt.
d) Ammonia và carbon dioxide được sử dụng quay vòng trong quá trình sản xuất.
Câu 4: Các muối carbonate của kim loại nhóm IIA đều bị phân hủy bởi nhiệt. Xét phản ứng nhiệt phân: $MCO_3(s) \xrightarrow{t°} MO(s) + CO_2(g)$ $\Delta_r H_{298}°$
Cho biết:
| Muối | $Mg-CO_3(s)$ | $Ca-CO_3(s)$ | $Sr-CO_3(s)$ | $Ba-CO_3(s)$ |
|---|---|---|---|---|
| $\Delta_r H_{298}°$(kJ) | 100,7 | 179,2 | 234,6 | 271,5 |
(Nguồn: John A. Dean (1999), Hand book of Chemistry, Fifteenth Edition, McGraw-Hill, Inc.) Nhiệt độ bắt đầu xây ra phân ứng nhiệt phân (sắp xếp ngẫu nhiên) các muối carbonate là 882°C; 1360°C; 542°C; 1155°C.
a) Độ bền nhiệt của các muối tăng dần từ $MgCO_3$ đến $BaCO_3$.
b) Các phân ứng nhiệt phân ở trên đều là phản ứng tỏa nhiệt.
c) Ở nhiệt độ 1155°C, phân ứng nhiệt phân $SrCO_3$ bắt đầu xây ra.
d) Trong quá trình nưng với xây ra phân ứng nhiệt phân $CaCO_3$.
PHẦN III. Câu trắc nghiệm yêu cầu trả lời ngắn.
Thí sinh trả lời từ câu 1 đến câu 4.
Câu 1: Cho các kim loại Ag, Al, Cu, Fe, Mg, Na, Sn, Zn. Số kim loại được điều chế trong phòng thí nghiệm bằng phương pháp thủy luyện là bao nhiêu?
Câu 2: Tiến hành điện phân với điện cực trơ có màng ngăn 200 mL dung dịch NaCl cho tới khi cathode thoát ra 0,2479 L khí (đkc) thì ngừng điện phân. Tính pH của dung dịch sau điện phân.
Câu 3: Cho các nhận định sau về tác hại của nước cứng: (1) làm giảm bọt khi giặt quần áo bằng xà phòng; (2) làm đường ống dẫn nước đóng cặn, giảm lưu lượng nước; (3) làm thức ăn lâu chín và giảm mùi vị; (4) làm nổi hơi phù cận, gây tốn nhiên liệu và có nguy cơ gây nổ. Số nhận định đúng là
A. 2.
B. 1.
C. 3.
D. 4.
Câu 4: Tiến hành thí nghiệm theo các bước sau:
Bước 1: Dùng pipette hút chính xác 5,00 mL dung dịch $FeSO_4$ nồng độ a mol/L cho vào bình định mức loại 50 mL. Thêm tiếp nước cất và định mức đến vạch, thu được 50 mL dung dịch Y.
Bước 2: Chuẩn độ 10,00 mL dung dịch Y trong môi trường $H_2SO_4$ loãng cần vừa đủ 8,80 mL dung dịch $KMnO_4$ 0,02M
Giá trị của a là bao nhiêu? (Làm tròn kết quả đến phần trăm).
Câu 5: Khi 100,0 kg sắt lên gỉ sắt hoàn toàn thì tạo thành bao nhiêu kg gỉ sắt? (Giả thiết công thức hóa học của gỉ sắt là $Fe_2O_3 \cdot 3H_2O$.) (Làm tròn kết quả đến phần nguyên).
Câu 6: Ở điều kiện thường, tính thể Ca có D = 1,55 g/cm³. Giả thiết các nguyên tử Ca là những hình cầu chiếm 74% thể tích tính thể, phần còn lại là khe rỗng. Cho biết: $V = \frac{4}{3} \cdot \pi \cdot r^3$
- Công thức tính thể tích hình cầu:
- Số Avogadro $N_A = 6,023 \cdot 10^{23}$ và số pi $\pi = 3,1416$. Bán kính nguyên tử Ca là bao nhiêu pm? (Làm tròn kết quả đến phần nguyên).

ThS. Lê Thị Mai Nhi
(Người kiểm duyệt, ra đề)
Chức vụ: Trưởng ban biên soạn môn Hoá Học THPT
Trình độ: Thạc sĩ Hóa học, Chứng chỉ hạng II, Chứng chỉ STEM, Ngoại ngữ B1
Kinh nghiệm: 10+ năm kinh nghiệm tại Trường THPT Chuyên Nguyễn Huệ

