Chọn đến phần học sinh cần nhanh chóng thông qua mục lục bằng cách click đến phần đó
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn.
Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn 1 phương án.
Câu 1:
Một học sinh chuẩn bị thí nghiệm: Zn dạng viên và dạng bột; Ống nghiệm (I) và (II) đều chứa 3 mL dung dịch $H_2SO_4$ 0,5M để hòa tan lượng Zn sẽ cho vào; Dung dịch $MgSO_4$ và dung dịch $CuSO_4$.
Phán đoán nào sau đây của học sinh là đúng?
A. Nếu Zn tan trong dung dịch $H_2SO_4$ 0,5M thì sẽ tạo ra khí $SO_2$
B. Nếu cho bột Zn vào (I) đồng thời cho viên Zn có cùng khối lượng vào (II) thì cho đến khi kết thúc phản ứng lượng khí thoát ra ở (I) nhiều hơn ở (II).
C. Nếu cho viên Zn vào (I) đồng thời cho viên Zn có cùng khối lượng vào (II) rồi thêm tiếp vài mL dung dịch $H_2SO_4$ 0,5M vào (II) thì tốc độ hòa tan kim loại ở ống nghiệm này sẽ nhanh hơn.
D. Nếu cho viên Zn và vài giọt dung dịch $MgSO_4$ vào (I), cho viên Zn và vài giọt dung dịch $CuSO_4$ vào (II) thì sự ăn mòn điện hóa chỉ xảy ra ở (II).
Câu 2:
Nhờ tính chất vật lí nào sau đây mà người ta có thể uốn cong được kim loại?
A. Tính dẻo.
B. Tính dẫn điện.
C. Tính dẫn nhiệt.
D. Tính ánh kim.
Câu 3:
Phương pháp điều chế NaOH trong công nghiệp là
A. Cho kim loại Na tác dụng với nước.
B. Cho $Na_2O$ tác dụng với nước.
C. Điện phân dung dịch NaCl bão hòa có màng ngăn.
D. Điện phân dung dịch NaCl bão hòa, không có màng ngăn.
Câu 4:
Cho một miếng Cu vào ống nghiệm, sau đó nhỏ thêm 2 mL dung dịch $H_2SO_4$ 10%. Hiện tượng quan sát được là
A. dung dịch chuyển sang màu xanh lam.
B. có bọt khí không màu thoát ra.
C. dung dịch chuyển sang màu vàng.
D. miếng Cu không tan.
Câu 5:
Số phối tử trong phức chất $Cu[(NH_3)_4(H_2O)_2](OH)_2$ bằng bao nhiêu?
A. 4.
B. 6.
C. 2.
D. 8.
Câu 6:
Trong cuộc sống hàng ngày, chúng ta thường thu gom các rác thải kim loại như vỏ lon bia, sắt thép phế liệu. Mục đích chính của việc thu gom này là để

A. tái chế kim loại.
B. đem đốt, tiêu hủy
C. làm đồ chơi.
D. làm nhiên liệu.
Câu 7:
Trong tự nhiên, Sodium có nhiều trong quặng nào sau đây?
A. Halite.
B. Bauxite.
C. Dolomite.
D. Phosphorite.
Câu 8:
Cho lần lượt các kim loại Be, Mg, Ca và Ba vào nước. Kim loại phản ứng nhanh với nước ở nhiệt độ thường là
A. Mg và Ca.
B. Ca và Ba.
C. Mg và Ba.
D. Be và Mg.
Câu 9:
Nước cứng có rất nhiều tác hại đối với đời sống và sản xuất như làm tắc đường ống dẫn nước, giảm tác dụng giặt rửa của xà phòng…Để làm mềm một loại nước cứng vĩnh cửu bằng phương pháp kết tủa, ta dùng hóa chất nào sau đây?
A. $Na_2CO_3$.
B. NaCl.
C. $NaNO_3$
D. $CaCl_2$.
Câu 10:
Trong ion phức chất $[Co(NH_3)_6]^{3+}$, nguyên tử trung tâm là
A. $Co^{3+}$.
B. N.
C. H.
D. $NH_3$.
Câu 11:
Nhiều thiết bị, đồ dùng phục vụ cho đời sống và sản xuất được làm từ hợp kim. Hợp kim là
A. vật liệu kim loại có chứa một kim loại cơ bản và một số kim loại khác hoặc phi kim.
B. hỗn hợp đồng nhất của hai hay nhiều kim loại hoặc kim loại và phi kim.
C. hợp chất của một kim loại với một phi kim.
D. hỗn hợp kim loại và hợp chất của chúng.
Câu 12:
$NaHCO_3$ được sử dụng là phụ gia thực phẩm với tên gọi baking soda, có kí hiệu là E500(ii) dùng làm chất điều chỉnh độ chua trong sốt cà chua, nước ép hoa quả… Khi đó, $NaHCO_3$ sẽ tác dụng với $H^+$ để làm giảm nồng độ $H^+$. Vai trò của $NaHCO_3$ trong phản ứng đó là
A. acid.
B. chất oxi hóa.
C. chất khử.
D. base.
Câu 13:
Người ta tách kim loại Ag bằng phương pháp cyanide: Nghiền nhỏ quặng silver sulfide (chứa $Ag_2S$, Ag) rồi hòa tan bằng dung dịch chứa phức $Na_2[Ag(CN)_2]$. Sau đó dùng Zn (dư) để khử ion Ag+ trong phức để thu được dung dịch chứa $Na_2[Zn(CN)_4]$ và chất rắn chứa Ag. Cách ứng dụng dung dịch $H_2SO_4$ (loãng, dư) để hòa tan Zn dư vì thực được Ag. Nếu sử dụng 1,50 kg Zn thì sau khi các phản ứng xảy ra hoàn toàn, thu được 4,52 gam chất rắn gồm Ag và Zn dư. Hỏi lượng Ag thu được trong quá trình này là bao nhiêu kg?
A. 2,75.
B. 4,32.
C. 2,16.
D. 3,24.
Câu 14:
Độ tan của $Ca(OH)_2$ ở 20°C là 0,173 g/100 g nước. Biết khối lượng riêng của dung dịch $Ca(OH)_2$ bão hòa ở 20°C là 1g/mL. Nồng độ mol của ion $Ca^{2+}$ trong dung dịch bão hòa $Ca(OH)_2$ ở 20°C có giá trị gần đúng là
A. 1,730.
B. 0,940.
C. 0,023.
D. 0,047.
Câu 15:
Cho các phát biểu sau:
(1) Nguyên tử của các nguyên tố kim loại thường có từ 1 electron đến 3 electron ở lớp electron ngoài cùng.
(2) Tất cả các nguyên tố nhóm B đều là kim loại.
(3) Ở trạng thái rắn, đơn chất kim loại có cấu tạo tinh thể.
(4) Các kim loại đều có bán kính nguyên tử nhỏ hơn bán kính nguyên tử của các phi kim thuộc cùng một chu kì.
(5) Liên kết kim loại được hình thành do lực hút tĩnh điện giữa các electron tự do với các ion dương kim loại trong mạng tinh thể kim loại.
Số phát biểu đúng là
A. 5
B. 2
C. 3
D. 4
Câu 16:
Trong quy trình tách kim loại Ag từ quặng $Ag_2S$, sử dụng chất nào để hòa tan $Ag_2S$?
A. $CO_2$.
B. NaCN.
C. NaCl.
D. $H_2O$.
Câu 17:
Tấm tôn lớp nhà thường được làm từ vật liệu thép tráng kẽm hoặc thép tráng hỗn hợp nhôm và kẽm. Mục đích của việc làm trên là

A. giúp bảo vệ bề mặt của vật liệu thép, tránh tiếp xúc trực tiếp với các chất trong môi trường.
B. dùng phương pháp điện hóa bảo vệ vật liệu thép không bị ăn mòn khi tiếp xúc với các chất trong môi trường.
C. giúp tấm tôn lớp nhà đẹp hơn nên bền hơn.
D. giúp tấm tôn lớp được nhẹ, sáng đẹp và bền hơn.
Câu 18:
Cationite là một loại nhựa trao đổi cation được sử dụng để loại bỏ ion $Ca^{2+}$, $Mg^{2+}$. Khi nước cứng đi qua cột nhựa, các ion $Ca^{2+}$, $Mg^{2+}$ (kí hiệu chung là $M^{2+}$) sẽ được giữ lại và thay thế bằng các ion $H^+$, $Na^+$ theo phản ứng sau:
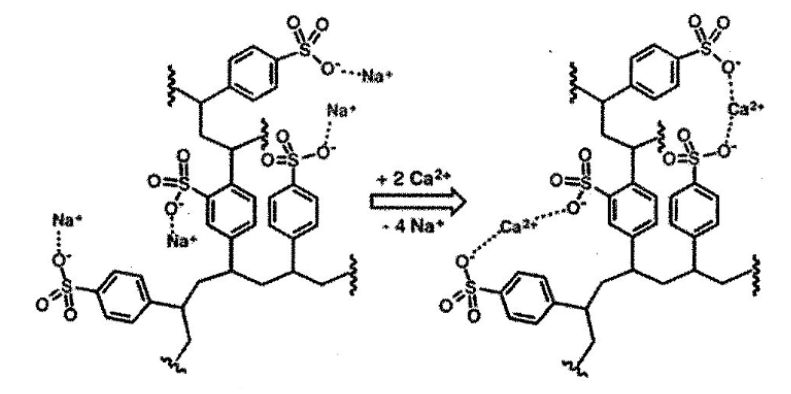
$M^{2+} +2R-SO_3X → (R-SO_3)_2M + 2X^+$ ($X^+$ là $H^+$ hoặc $Na^+$)
Một loại cationite có % khối lượng lượng sulfur là 7,94% được sử dụng để loại bỏ các ion $Mg^{2+}$, $Ca^{2+}$ trong nước cứng. Giả sử một cột nhựa trao đổi ion trong thiết bị lọc nước gia đình có khối lượng cationite là 1,00 kg thì số mol $Mg^{2+}$, $Ca^{2+}$ tối đa có thể được loại bỏ là (kết quả làm tròn đến hàng phần trăm)
A. 1,24 mol.
B. 0,62 mol.
C. 2,48 mol.
D. 1,86 mol.
PHẦN II. Câu hỏi trắc nghiệm đúng sai.
Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu thí sinh chọn đúng hoặc sai.
Câu 1:
Trong tự nhiên quặng bauxite có thành phần chính là $Al_2O_3$. Quặng bauxite mỏ Tây Tân Rai – Lâm Đồng nổi tiếng cả nước về các mỏ thuộc vùng Tây nguyên của Việt Nam nói chung là loại quặng bauxite có nguồn gốc phong hóa từ các loại đá bazan, quặng thường có màu nâu sẫm, nâu đỏ, hoặc xám, xám phớt vàng.
a) Quặng bauxite là nguyên liệu dùng để sản xuất aluminium (nhôm) trong công nghiệp.
b) Để thu được kim loại Al từ quặng bauxite người ta dùng phương pháp điện phân nóng chảy $Al_2O_3$.
c) Bề điện phân $Al_2O_3$ nóng chảy có các điện cực làm bằng thép.
d) Có phương trình nhiệt hóa học: $2Al_2O_3(s) → 4Al(s) + 3O_2 (g)$ $ΔH°_{298}= 1676,00$ kJ. Để thu được 1 tấn Al với hiệu suất sử dụng năng lượng đạt 75% và 1 kWh = $3,6×10^6$ J, thì cần tiêu tốn 5747,6 kWh.
Câu 2:
Xét một thí nghiệm về sự ăn mòn điện hóa: Nhúng một thanh kẽm và một thanh đồng vào cốc đựng dung dịch sulfuric acid loãng. Nối thanh kẽm với thanh đồng bằng dây dẫn và cho đi qua một volt kế.
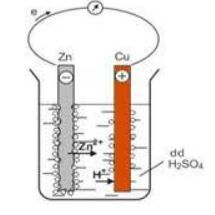
a) Khi chưa nối dây dẫn, phản thanh kẽm trong dung dịch bị hòa tan và bọt khí hydrogen thoát ra ở bề mặt thanh kẽm.
b) Khi nối dây dẫn, kim volt kế bị lệch, bọt khí hydrogen thoát ra ở cả thanh đồng, phần thanh kẽm trong dung dịch bị ăn mòn nhanh.
c) Khi nối dây dẫn, một pin điện hóa đã được hình thành với kẽm là điện cực âm, đồng là điện cực dương.
d) Khi nối dây dẫn, thanh kẽm chỉ bị ăn mòn điện hóa.
Câu 3:
Khi sử dụng dung dịch potassium hydroxide để nhận biết các dung dịch riêng biệt copper(II) sulfate và iron(II) sulfate, hiện tượng quan sát được như sau:
a) Đều tạo thành kết tủa màu xanh.
b) Có kết tủa bị chuyển dần sang màu nâu đỏ.
c) Các dung dịch loãng của copper(II) sulfate và iron(II) sulfate đều có màu xanh dương.
d) Nhỏ dư dung dịch potassium hydroxide vào dung dịch copper(II) sulfate sẽ thu được dung dịch trong suốt có màu xanh.
Câu 4: Để xác định hàm lượng $Fe^{2+}$ trong một lọ muối Mohr (có công thức $(NH_4)_2FeSO_4.6H_2O$) người ta tiến hành thí nghiệm như sau:
Cân 5,00 gam muối rồi hòa tan vào nước, thêm tiếp 5 mL dung dịch $H_2SO_4$ 20% rồi cho nước cất vào để được 100 mL dung dịch (kí hiệu là dung dịch X). Lấy 10 mL dung dịch X đem chuẩn độ bằng dung dịch chuẩn $KMnO_4$ 0,02 M thì thấy hết 10 mL.
a) Phương trình phản ứng chuẩn độ là: $6FeSO_4 + 2KMnO_4 + 4H_2SO_4 → 3Fe_2(SO_4)_3 + K_2SO_4 + 2MnO_2 + 4H_2O$.
b) Thời điểm kết thúc chuẩn độ là lúc dung dịch xuất hiện màu hồng và tồn tại khoảng 20 giây.
c) Khi để trong không khí lâu ngày thì hàm lượng $FeSO_4$ trong muối Mohr sẽ thay đổi.
d) Hàm lượng $Fe^{2+}$ trong mẫu muối Mohr đem phân tích ở trên là 1,12%.
PHẦN III. Câu trắc nghiệm yêu cầu trả lời ngắn.
Thí sinh trả lời từ câu 1 đến câu 4.
Câu 1:
Một số hợp chất của kim loại kiềm như sodium chloride, sodium hydroxide, sodium hydrogencarbonate (baking soda), sodium carbonate (soda),… có nhiều ứng dụng trong đời sống và sản xuất.
Cho các phát biểu sau:
a) Soda được dùng làm nguyên liệu trong sản xuất thủy tinh, giấy, xà phòng, chất tẩy rửa,…
b) Trong quá trình sản xuất soda theo phương pháp Solvay có tạo ra muối sodium hydrogencarbonate, muối này được tách ra khỏi hỗn hợp phản ứng nhờ khả năng tan tốt trong nước của nó.
c) Trong y học, sodium carbonate được sử dụng để làm giảm chứng đau dạ dày do dư acid.
d) Sodium hydroxide, khí chlorine, khí hydrogen là các sản phẩm thu được từ công nghiệp khi điện phân dung dịch sodium chloride bão hòa có màng ngăn.
Số phát biểu đúng là:…
Câu 2:
Đá vôi là loại đá trầm tích bao gồm các khoáng vật calcite và các dạng kết tinh khác nhau của calcium carbonate. Đá vôi hay còn gọi là calcium carbonate là một trong những vật liệu hữu ích và linh hoạt đối với con người. Đá vôi rất phổ biến được sử dụng để tim thấy trên thế giới trong trầm tích, đá biển chất và đá lửa. Đá vôi tì khi ở dạng tinh khiết mà thường bị lẫn các tạp chất như đá phiến silic, đá macma, silica, đất sét, bùn, cát… Trong quá trình sản xuất vôi sống từ đá vôi xảy ra phản ứng sau :
$CaCO_3(s) \xrightarrow{t°} CaO(s) + CO_2(g)$ $\Delta_r H°_{298} = 178,29$ kJ/mol
Nung 1 tấn đá vôi chứa 8% tạp chất , hiệu suất phản ứng là 95% , thu được m tấn vôi sống. Giá trị m là (Kết quả làm tròn đến hàng phần trăm).
Câu 3:
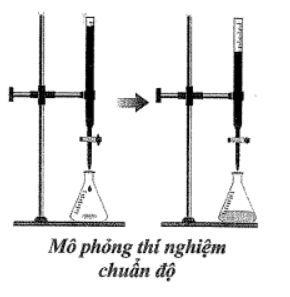
Để xác định nồng độ mol của dung dịch NaOH, người ta đã tiến hành thực hiện thí nghiệm như sau:
- Cho dung dịch NaOH vào đầy burette (loại 25 mL) đến vạch 0.
- Lấy 10 mL dung dịch HCl 0,1 M cho vào bình tam giác (loại 100 mL), sau đó nhỏ thêm vài giọt phenolphthalein vào.
- Nhỏ từ từ dung dịch NaOH từ burette vào bình tam giác (hình bên dưới), cho đến khi dung dịch chuyển màu hồng nhạt (màu ổn định trong khoảng 30 giây) thì dừng lại.
- Đọc thể tích dung dịch NaOH trên burette, thấy hết 10 mL.
Nồng độ mol của dung dịch NaOH là bao nhiêu?
Câu 4:
Cho 13,6 gam hỗn hợp gồm Fe và Cu vào dung dịch $H_2SO_4$ loãng dư, thu được 4,958 lít khí $H_2$ (đkc); m (gam) chất rắn không tan X và dung dịch chứa Y. Giá trị m là bao nhiêu?
Câu 5:
Vàng (Au) đơn chất tồn tại trong tự nhiên ở trong quặng vàng thường có hàm lượng vàng thấp. Để thu hồi vàng từ quặng vàng, người ta nghiền quặng, hòa tan chúng vào dung dịch KCN và liên tục sục không khí vào. Vàng bị hòa tan tạo thành phức chất:
$4Au(s) + 8KCN(aq) + O_2(g) + 2H_2O(l) → 4KAu(CN)_2 + 4KOH(aq)$ (1)
và sau đó kết tủa vàng bằng kẽm (Zn):
$Zn(s) + 2K[Au(CN)_2] (aq) → K_2Zn(CN)_4 + 2Au(s)$ (2)
Nếu dùng 13 kg KCN thì có thể tách được bao nhiêu kg vàng từ quặng theo chuỗi phản ứng trên? Giả thiết các chất khác trong quặng không phản ứng với KCN.
Câu 6:
Một hộ gia đình mua vôi sống để khử chua cho một thửa ruộng có diện tích là 720 m² với liều lượng 2 kg/100 m². Biết giá vôi sống là 20 nghìn đồng/kg. Hộ gia đình trên cần bao nhiêu nghìn đồng để mua vôi sống?

ThS. Lê Thị Mai Nhi
(Người kiểm duyệt, ra đề)
Chức vụ: Trưởng ban biên soạn môn Hoá Học THPT
Trình độ: Thạc sĩ Hóa học, Chứng chỉ hạng II, Chứng chỉ STEM, Ngoại ngữ B1
Kinh nghiệm: 10+ năm kinh nghiệm tại Trường THPT Chuyên Nguyễn Huệ

.jpg?alt=media&token=270e4035-78b4-4a07-b95f-4c1a4fc8f099)