Chọn đến phần học sinh cần nhanh chóng thông qua mục lục bằng cách click đến phần đó
Cho nguyên tử khối: H = 1, C = 12, N = 14, O = 16, Na = 23, Mg = 24, Al = 27, Cl = 35,5, Fe = 56, Cu = 64, Zn = 65, Ag = 108.
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn.
Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1. Có thể sử dụng phương pháp điện phân dung dịch muối để điều chế đây các kim loại nào sau đây?
A. Mg, Cu, Zn
B. Fe, Al, Cr
C. Ag, Cu, Fe
D. Au, Ag, Ca
Câu 2. Ở nhiệt độ thường, có thể dùng thùng phuy bằng thép để đựng dung dịch nào sau đây?
A. HCl đặc
B. $H_2SO_4$ loãng
C. $H_2SO_4$ đặc
D. $HNO_3$ loãng
Câu 3. Cấu hình electron nào sau đây không phải của nguyên tử kim loại?
A. $[Ne]3s^23p^5$
B. $[Ne]3s^2$
C. $[Ar]3d^54s^2$
D. $[Ar]3d^{10}4s^2$
Câu 4. Nếu dùng kim loại kẽm thì có thể tách được từng kim loại trong dãy ion kim loại riêng biệt nào sau đây?
A. $Sn^{2+}$, $Pb^{2+}$, $Cu^{2+}$
B. $Mg^{2+}$, $Pb^{2+}$, $Cu^{2+}$
C. $Pb^{2+}$, $Ag^+$, $Al^{3+}$
D. $Ag^+$, $Cu^{2+}$, $Na^+$
Câu 5. Các đơn chất kim loại có một số tính chất vật lí chung là do
A. chúng có cấu trúc mạng tinh thể
B. chúng có các electron tự do
C. chúng có ít electron hóa trị
D. chúng có năng lượng ion hóa nhỏ
Câu 6. Kim loại tungsten (W) được sử dụng làm dây tóc bóng điện. Ứng dụng này được dựa trên cơ sở tính chất vật lí nào sau đây của tungsten?
A. Tính dẫn nhiệt
B. Tỉ trong nhỏ
C. Tính dẻo
D. Nhiệt độ nóng chảy cao
Câu 7. Nếu vật dụng được làm bằng tôn (sắt tráng kẽm) bị ăn mòn điện hóa trong không khí ẩm thì
A. kẽm đóng vai trò là cathode và bị oxi hóa
B. sắt đóng vai trò là cathode và bị oxi hóa
C. kẽm đóng vai trò là anode và bị oxi hóa
D. sắt đóng vai trò là anode và bị oxi hóa
Câu 8. Người ta có thể tách các cation kim loại ra khỏi dung dịch bằng cách điện phân toàn phần (điện phân không chế hạn thế áp điện hiện thể ấp đặt vào hai cực), khi đó cation có tính oxi hóa lớn hơn sẽ điện phân trước và tách ra trước. Điện phân phân đoạn (với điện cực trơ) dung dịch có chứa các ion $Ag^+$, $Cu^{2+}$, $Ni^{2+}$ và $Mg^{2+}$ với anion là $NO_3^-$. Cation nào sẽ điện phân trước tại cathode?
A. $Ni^{2+}$
B. $Cu^{2+}$
C. $Mg^{2+}$
D. $Ag^+$
Câu 9. Kim loại nào sau đây là kim loại kiềm?
A. Ba
B. Li
C. Al
D. Cu
Câu 10. Ở điều kiện thường, các đơn chất kim loại kiềm có cấu trúc mạng tinh thể
A. lập phương tâm khối
B. lập phương tâm diện
C. lục phương
D. tùy vào bản chất của từng nguyên tố
Câu 11. Nếu thực hiện hoàn toàn các quá trình thí trường hợp nào sau đây không còn tồn tại ion $Na^+$?
A. Nhiệt phân $NaHCO_3$
B. Điện phân dung dịch NaOH
C. Điện phân nóng chảy NaCl
D. Điện phân dung dịch NaCl
Câu 12. Trường hợp nào sau đây có thể tạo ra kim loại?
A. Nung hỗn hợp gồm quặng apatite và than cốc trong lò đứng
B. Đốt quặng pyrite trong oxygen
C. Đốt quặng silver sulfide trong oxygen dư
D. Nung hỗn hợp gồm quặng bauxite và than cốc trong lò điện
Câu 13. Phát biểu nào sau đây không đúng?
A. Các kim loại kiềm có màu trắng bạc và có ánh kim
B. Trong tự nhiên, các kim loại kiềm chỉ tồn tại ở dạng hợp chất
C. Các kim loại kiềm nhẹ hơn nước
D. Kim loại kiềm có nhiệt độ nóng chảy và nhiệt độ sôi thấp
Câu 14. Cho các phát biểu:
(a) Hợp kim được sử dụng trong đời sống và sản xuất phổ biến hơn so với kim loại.
(b) Kim loại A có nhiệt độ nóng chảy cao hơn kim loại B, nhiệt độ nóng chảy của hợp kim A-B luôn cao hơn nhiệt độ nóng chảy của B.
(c) Tính chất hóa học của hợp kim thường tương tự tính chất của các kim loại thành phần.
(d) Hợp kim có thể cứng hơn rất nhiều các kim loại tạo nên nó.
(e) Hợp kim thường khó bị oxi hóa hơn các đơn kim loại thành phần.
Số phát biểu đúng là
A. 2
B. 3
C. 5
D. 4
Câu 15. Người ta tách kim loại Ag bằng phương pháp cyanide: Nghiền nhỏ quặng silver sulfide (chứa $Ag_2S$, Ag) rồi hòa tan bằng dung dịch NaCN, lọc lấy phần dung dịch chứa phức $Na[Ag(CN)_2]$. Sau đó dùng Zn (dư) để khử ion $Ag^+$ trong phức thu được dung dịch chứa $Na_2[Zn(CN)_4]$ và chất rắn chứa Ag và Zn. Cuối cùng dùng dung dịch $H_2SO_4$ (loãng, dư) để hòa tan Zn dư và thu được Ag. Nếu sử dụng 1,50 kg Zn thì sau khi các phản ứng xảy ra hoàn toàn, thu được 4,52 kg chất rắn gồm Ag và Zn dư. Khối lượng Ag thu được trong quá trình này là bao nhiều kg?
A. 2,75
B. 4,32
C. 2,16
D. 3,24
Câu 16. Phát biểu nào sau đây không đúng?
A. Tính chất hóa học đặc trưng của kim loại là tính khử.
B. Ăn mòn hóa học là sự phá hủy kim loại dưới tác dụng của môi trường.
C. Ăn mòn điện hóa là quá trình ăn mòn kim loại do sự tạo thành pin điện hóa.
D. Ăn mòn điện hóa xảy ra khi hai kim loại được nhúng vào dung dịch chất điện li.
Câu 17. Sodium bicarbonate ($NaHCO_3$) được dùng để làm thuốc đau dạ dày do thừa acid. Khi sử dụng thuốc sẽ xảy ra phản ứng trung hòa acid trong dạ dày: $HCO_3^- + H^+ → H_2O + CO_2$. Trong phản ứng trên $NaHCO_3$ thể hiện tính chất
A. acid
B. base
C. lưỡng tính
D. trung tính
Câu 18. Để cho một mạ chromium (Cr) cho một vật, người ta điện phân dung dịch chứa $K_2Cr_2O_7$ và $H_2SO_4$ với một điện cực là vật cần mạ chromium. Vật cần mạ được nối với cực nào của dòng điện một chiều và được gọi là anode hay cathode?
A. Cực âm, cathode
B. Cực âm, anode
C. Cực dương, anode
D. Cực dương, cathode
PHẦN II. Câu trắc nghiệm đúng sai.
Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Câu 1. Vỏ tàu biển làm bằng thép, khi sử dụng lâu ngày sẽ bị gỉ.
a. Vỏ tàu bị gỉ chủ yếu do xảy ra ăn mòn điện hóa học.
b. Để chống sự ăn mòn vỏ tàu người ta phải phủ kín vỏ tàu bằng một lớp sơn.
c. Vỏ tàu bị ăn mòn là do sắt tác dụng với NaCl trong nước biển.
d. Người ta gắn một số tấm kẽm (Zn) vào phần chìm dưới nước của vỏ tàu để hạn chế sự ăn mòn.
Câu 2. Mỗi phát biểu sau đây là đúng hay sai?
a. Ở điều kiện thường, tất cả các kim loại đều tồn tại ở thể rắn và có cấu tạo tinh thể.
b. Cho mảnh nhỏ Na vào dung dịch $FeSO_4$, thu được chất rắn là kim loại Fe.
c. Tái chế kim loại là giải pháp giúp con người sử dụng hiệu quả hơn nguồn tài nguyên.
d. Dùng bột sulfur (S) để sử lý thủy ngân rời vải khi nhiệt kế bị vỡ.
Câu 3. Trong công nghiệp, một lượng lớn $NaHCO_3$ và $Na_2CO_3$ được sản xuất theo phương pháp Solvay bằng cách cho khí $CO_2$ (lấy từ nhiệt phân đá vôi) vào dung dịch chứa sodium chloride (NaCl) bão hòa và ammonia ($NH_3$) bão hòa.
$CO_2(aq) + H_2O(l) + NH_3(aq) + NaCl(aq) → NH_4Cl(aq) + NaHCO_3(s)$ (1)
$NaHCO_3$ tách ra đem nhiệt phân thu được soda: $2NaHCO_3 \xrightarrow{t^o} Na_2CO_3 + CO_2 + H_2O$ (2)
và $NH_4Cl$ được sử dụng để tái tạo $NH_3$ bằng cách tác dụng với $Ca(OH)_2$ tạo ra từ CaO.
a. Phản ứng (1) xảy ra được là do $NaHCO_3$ có độ tan kém hơn nên bị kết tinh trước.
b. Trong thực tế sản xuất, người ta đun nóng hỗn hợp các chất tham gia phản ứng (1) để thu được $Na_2CO_3$ ngay.
c. Nguyên liệu chính ban đầu của quá trình sản xuất soda bằng phương pháp Solvay là NaCl và $Ca(OH)_2$.
d. $NaHCO_3$ được ứng dụng làm bột nở là do phản ứng (2).
Câu 4. Sodium được sản xuất trong công nghiệp bằng cách điện phân muối ăn ở trạng thái nóng chảy ở nhiệt độ khoảng 800°C. Sơ đồ bình điện phân được mô tả như hình sau:
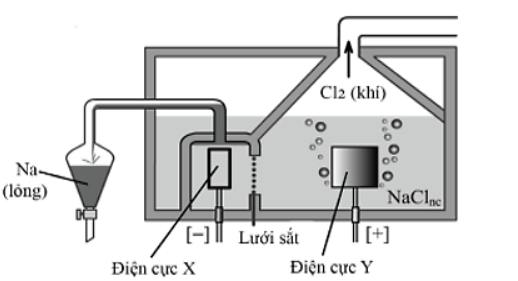
a. Trong quá trình sản xuất sodium, người ta sử dụng điện cực X làm bằng than chì, điện cực Y làm bằng kim loại Fe.
b. Hệ thống ống dẫn sodium và bình thu sodium nóng chảy luôn được đặt trong môi trường khí trơ.
c. Hệ thống thu kim loại sodium được lắp đặt phía trên bề mặt bình điện phân do sodium thu được ở thể lỏng.
d. Với một quy mô sản xuất ở mức trung bình, người ta dùng cường độ dòng điện là 9000 A thì sau 1,0 giờ sản xuất được xấp xỉ 6,18 kg sodium (hiệu suất tổng thể của cả quá trình đạt 80%, cho hằng số Faraday F = 96500 C/mol).
PHẦN III: Câu trắc nghiệm yêu cầu trả lời ngắn.
Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1. Trong môi trường trung tính có quá trình sau: $2H_2O + 2e → 2OH^- + H_2$; $E^0_{H_2O/2OH^-,+H_2} = -0,431V$. Cho thế điện cực chuẩn của một số kim loại: $E^0_{Al^5+/Al} = -0,257V$, $E^0_{Mg^{2+}/Mg} = -2,356V$, $E^0_{Ni^{2+}/Ni} = -0,257V$, $E^0_{Na^+/Na} = -2,713V$. Trong các kim loại Al, Mg, Ni, Na, có bao nhiều kim loại không thể phân ứng với nước ở điều kiện chuẩn?
Câu 2. Cho khối lượng riêng của các chất:
| Chất | Li | Na | K | Ca | Dầu hỏa |
|---|---|---|---|---|---|
| Khối lượng riêng (g/cm³) | 0,53 | 0,97 | 0,86 | 1,54 | 0,80 |
Để bảo quản kim một số kim loại mạnh, người ta ngâm chìm các kim loại đó vào trong dầu hỏa. Hãy cho biết, có bao nhiêu kim loại bảo quản được bằng cách cho vào dầu hỏa?
Câu 3. Cho các thí nghiệm sau:
(1) Dẫn khí CO (dư) qua bột CuO đun nóng.
(2) Nung nóng hỗn hợp Al và $Fe_2O_3$ (không có không khí).
(3) Cho kim loại Mg vào dung dịch $FeCl_3$ dư.
(4) Điện phân dung dịch KCl (điện cực trơ, màng ngăn xốp).
Liệt kê các thí nghiệm có thể tạo thành kim loại theo dãy số thứ tự tăng dần (Ví dụ: 124, 23,…).
Câu 4. Điện phân nóng chảy hỗn hợp gồm $Al_2O_3$ (10%) và cryolite (90%) với anode và cathode là than chì. Sau thời gian điện phân thu được 5,4 tấn Al tại cathode và hỗn hợp khí tại anode gồm $CO_2$ (khoảng 80%) và CO (20% theo thể tích). Giả thiết không có quá trình nào khác, quá trình điện phân. Tính khối lượng carbon (tính theo tấn) đã bị oxi hóa tại anode (làm tròn kết quả đến hàng phần mười).
Câu 5. Cho 15,0 gam hỗn hợp bột kim loại Zn và Cu vào dung dịch $H_2SO_4$ loãng dư, sau khi phản ứng xảy ra hoàn toàn thu được 4,958 lít khí $H_2$ (ở đktc) và m gam chất rắn không tan. Tính m (làm tròn kết quả đến hàng phần mười).
Câu 6. Một nhà máy hóa chất tiến hành điện phân dung dịch NaCl 20% không có màng ngăn, thu được nước Javel chứa NaClO 10%. Bỏ qua sự bay hơi nước khi điện phân. Phần trăm khối lượng của NaCl bị điện phân là bao nhiêu (làm tròn kết quả đến hàng phần mười)?

ThS. Lê Thị Mai Nhi
(Người kiểm duyệt, ra đề)
Chức vụ: Trưởng ban biên soạn môn Hoá Học THPT
Trình độ: Thạc sĩ Hóa học, Chứng chỉ hạng II, Chứng chỉ STEM, Ngoại ngữ B1
Kinh nghiệm: 10+ năm kinh nghiệm tại Trường THPT Chuyên Nguyễn Huệ

.jpg?alt=media&token=7074f1a3-c5f8-49ea-bc39-35efda368450)