Chọn đến phần học sinh cần nhanh chóng thông qua mục lục bằng cách click đến phần đó
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn.
Thí sinh trả lời từ câu 1 đến câu 20. Mỗi câu hỏi thí sinh chỉ chọn 1 phương án
Câu 1. (Biết) Kí hiệu cặp oxi hóa – khử ứng với quá trình khử: $Fe^{3+} + 1e \longrightarrow Fe^{2+}$ là
A. $Fe^{3+}/Fe^{2+}$
B. $Fe^{2+}/Fe$
C. $Fe^{3+}/Fe$
D. $Fe^{2+}/Fe^{3+}$
Câu 2. (Biết) Pin điện hóa Zinc carbon (Zn–C) đã được sử dụng từ lâu. Pin Zn–C có giá rẻ phù hợp cho các thiết bị tiêu thụ ít điện năng như điều khiển tivi, đồng hồ treo tường, đèn pin, đồ chơi, … Tuy nhiên, điện trở trong của loại pin này lớn, không phù hợp cho các thiết bị mạy ảnh. Khi pin này hoạt động thì

A. Zn đóng vai trò cực âm, C đóng vai trò cực dương
B. ở điện cực âm, anode xảy ra quá trình khử Zn
C. không phát sinh dòng điện
D. dòng electron chuyển từ cực dương sang cực âm
Câu 3.( Biết) Trong sơ đồ pin Zn-Cu (Pin Galvani), ở cathode xảy ra
A. quá trình khử: $Cu^{2+} + 2e \longrightarrow Cu$
B. quá trình oxi hóa: $Cu^{2+} + 2e \longrightarrow Cu$
C. quá trình khử: $Zn \longrightarrow Zn^{2+} + 2e$
D. quá trình oxi hóa: $Zn \longrightarrow Zn^{2+} + 2e$
Câu 4. (Biết) Cho bốn dung dịch: $Cu(NO_3)_2$ ; $AgNO_3$, $NaNO_3$, $MgCl_2$. Số dung dịch tác dụng với kim loại Fe là
A. 3
B. 4
C. 2
D. 1
Câu 5. (Biết) Kim loại nào sau đây dẻo nhất trong tất cả các kim loại?
A. Aluminium (Al)
B. Silver (Ag)
C. Copper (Cu)
D. Gold (Au)
Câu 6. (Biết) Hai kim loại đều phản ứng với dung dịch $Cu(NO_3)_2$ giải phóng kim loại Cu là
A. Al và Fe
B. Ag và Au
C. Al và Ag
D. Fe và Ag
Câu 7. (Hiểu) Loại M phản ứng được với: dung dịch HCl, dung dịch $Cu(NO_3)_2$, dung dịch $HNO_3$ (đặc, nguội). Kim loại M là
A. Al
B. Ag
C. Fe
D. Zn
Câu 8. (Hiểu) Đốt cháy hết 3,6 g một kim loại hóa trị II trong khí chlorine thu được 14,25 g muối khan của kim loại đó. Kim loại mang đốt là:
A. Zn
B. Cu
C. Mg
D. Ni
Câu 9. (Biết) Cho hỗn hợp Fe, Cu phản ứng với dung dịch $HNO_3$ loãng. Sau khi phản ứng hoàn toàn, thu được dung dịch chỉ chứa một chất tan và kim loại dư. Chất tan đó là
A. $Fe(NO_3)_3$
B. $Fe(NO_3)_2$
C. $HNO_3$
D. $Cu(NO_3)_2$
Câu 10. (Biết) Cho các cặp oxi hóa – khử của các kim loại và thế điện cực chuẩn tương ứng:
| Cặp oxi hóa – khử | $Li^+/Li$ | $Mg^{2+}/Mg$ | $Zn^{2+}/Zn$ | $Ag^+/Ag$ |
|---|---|---|---|---|
| Thế điện cực chuẩn,V | -3,040 | -2,356 | -0,762 | +0,799 |
Trong số các kim loại trên, kim loại có tính khử mạnh nhất là
A. Mg
B. Zn
C. Ag
D. Li
Câu 11. (Biết) Sự phá hủy kim loại do kim loại tác dụng trực tiếp với các chất oxi hóa trong môi trường gọi là
A. sự khử kim loại
B. sự tác dụng của kim loại với nước
C. sự ăn mòn hóa học
D. sự ăn mòn điện hóa
Câu 12. (Biết) Thiết lập pin điện hóa ở điều kiện chuẩn gồm hai điện cực tạo bởi các cặp oxi hóa – khử $Ni^{2+}/Ni$ ( $E^0_{Ni^{2+}/Ni} = -0,257V$ ) và $Cd^{2+}/Cd$ ( $E^0_{Cd^{2+}/Cd} = -0,403V$ ). Sức điện động chuẩn của pin điện hóa trên là:
A. +0,146 V
B. 0,000 V
C. -0,146 V
D. +0,660 V
Câu 13: (Biết) Nhóm những kim loại có độ dẫn điện tốt nhất là
A. Ag, Cu, Au
B. Cu, Al, Hg
C. Li, Na, K
D. Fe, Cu, Zn
Câu 14 (vận dụng): Cho các cặp oxi hóa – khử được sắp xếp theo thứ tự tăng dần tính oxi hóa của các ion kim loại: $Al^{3+}/Al$; $Fe^{2+}/Fe$, $Sn^{2+}/Sn$; $Cu^{2+}/Cu$. Tiến hành các thí nghiệm sau:
(a) Cho iron (Fe) vào dung dịch copper (II) sulfate.
(b) Cho copper (Cu) vào dung dịch aluminium sulfate.
(c) Cho tin (Sn) vào dung dịch copper (II) sulfate.
(d) Cho tin (Sn) vào dung dịch iron (II) sulfate.
Trong các thí nghiệm trên, những thí nghiệm có xảy ra phản ứng là
A. (b) và (c)
B. (a) và (c)
C. (a) và (b)
D. (b) và (d)
Câu 15: (vận dụng): Tiến hành các thí nghiệm sau:
(a) Cho lá Fe vào dung dịch gồm $CuSO_4$ và $H_2SO_4$ loãng.
(b) Đốt dây Fe trong bình đựng khí $O_2$.
(c) Cho lá Cu vào dung dịch gồm $Fe(NO_3)_3$ và $HNO_3$.
(d) Cho lá Zn vào dung dịch HCl.
Số thí nghiệm có xảy ra ăn mòn điện hóa là
A. 3
B. 2
C. 1
D. 4
Câu 16: (Biết) Một dung dịch X chứa đồng thời các chất sau: $NaNO_3$, $Cu(NO_3)_2$, $AgNO_3$. Thứ tự các kim loại thoát ra trên cathode khi điện phân dung dịch trên là:
A. Ag, Cu, Na
B. Ag, Na, Cu, Zn
C. Ag, Cu,
D. Cu, Ag
Câu 17: (Vận dụng) Cho các phát biểu sau:
(a) Điện phân dung dịch NaCl với điện cực trơ, thu được khí $H_2$ ở cathode.
(b) Dùng khí CO (dư) khử CuO nung nóng, thu được kim loại Cu.
(c) Để hợp kim Fe-Ni ngoài không khí ấm thì kim loại Ni bị ăn mòn điện hóa học.
(d) Dung dung dịch $Fe_2(SO_4)_3$ dư có thể tách Ag ra khỏi hỗn hợp Ag và Cu.
(e) Cho Fe dư vào dung dịch $AgNO_3$, sau phản ứng thu được dung dịch chứa hai muối Số phát biểu đúng là
A. 3
B. 2
C. 5
D. 4
Câu 18. (Vận dụng) Cho một số phương pháp bảo vệ kim loại khỏi bị ăn mòn
(1) Cách li kim loại với môi trường xung quanh.
(2) Dùng hợp kim chống gỉ.
(3) Dùng chất kìm hãm.
(4) Ngâm kim loại trong nước.
(5) Dùng phương pháp điện hóa.
Các phương pháp đúng là
A. (1), (3), (4), (5)
B. (1), (2), (3), (4)
C. (2), (3), (4), (5)
D. (1), (2), (3), (5)
PHẦN II. Câu hỏi trắc nghiệm đúng sai.
Thí sinh trả lời từ câu 1 đến câu 3. Trong mỗi ý a), b), c), d) ở mỗi câu thí sinh chọn đúng hoặc sai.
Câu 1: Các kim loại ở trạng thái rắn đều có tính dẻo, dẫn điện, dẫn nhiệt và có tính ánh kim.
a. (Biết) Các tính chất vật lý trên chủ yếu do các electron hóa trị tự do trong tinh thể kim loại gây ra.
b. (Biết) Kim loại dẻo nhất là Ag.
c. (Hiểu) Các kim loại dẫn điện tốt thì thường dẫn nhiệt tốt.
d. (Hiểu) Kim loại có tính ánh kim là do các electron tự do trong tinh thể kim loại phản xạ hầu hết những tia sáng mà mắt con người nhìn thấy được.
Câu 2. Hai kim loại X, Y và các dung dịch muối cloride của chúng có các phản ứng hóa học sau:
$X + 2YCl_3 \rightarrow XCl_2 + 2YCl_2$; $\quad Y + XCl_2 \rightarrow YCl_2 + X$.
a. (Vận dụng) Ion $Y^{2+}$ có tính oxi hóa mạnh hơn ion $X^{2+}$.
b. (Vận dụng) Kim loại X khử được ion $Y^{2+}$.
c. (Hiểu) Kim loại X có tính khử mạnh hơn kim loại Y.
d. (Vận dụng) Ion $Y^{3+}$ có tính oxi hóa mạnh hơn ion $X^{2+}$.
Câu 3: Cho 3 thí nghiệm sau:
– Thí nghiệm 1: Cho mẫu sodium vào nước đã thêm vài giọt dung dịch phenolphtalein.
– Thí nghiệm 2: Cho một mẫu Aluminium (nhôm) vào dung dịch hydrochloric acid loãng.
– Thí nghiệm 3: Cho một mẫu đồng vào dung dịch sulfuric acid đặc.
Mỗi phát biểu dưới đây là đúng hay sai?
a. (Hiểu) Các kim loại bị oxi hoá trong cả ba thí nghiệm trên.
b. (Hiểu) Cả ba thí nghiệm trên đều thu được khí không màu, nhẹ hơn không khí.
c. (Hiểu) Thí nghiệm 3 có sinh ra khí Z. Tỉ khối hơi của Z so với khí X thoát ra ở thí nghiệm 1 là 32.
d. (Vận dụng) Khí Z không có tính tẩy màu.
Câu 4: Trong công nghiệp, nhôm được điều chế bằng cách điện phân nóng chảy hỗn hợp alumina ($Al_2O_3$) và cryolite ($Na_3AlF_6$) còn gọi là quy trình Hall-Héroult: $2Al_2O_3(l) \longrightarrow 4Al(l) + 3O_2(g)$ như hình dưới đây. Nhiệt độ nóng chảy của hỗn hợp alumina và cryolite khoảng 950°C, thấp hơn nhiều so với nhiệt độ nóng chảy của alumina ($>2000^\circ C$); ngoài ra, cryolite còn làm tăng độ dẫn điện của hỗn hợp nóng chảy. Trong quá trình điện phân, cực dương làm bằng graphite bị ăn mòn và liên tục bị nhúng xuống bể điện phân. Sau một thời gian, các thanh graphite này sẽ được thay mới.
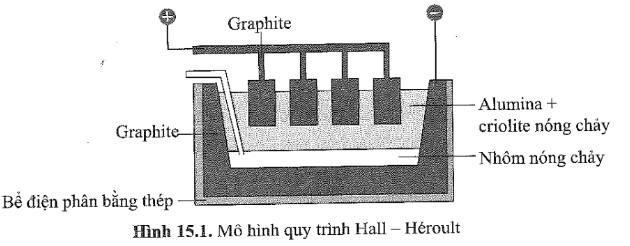
Mỗi phát biểu sau đây là đúng hay sai?
a. (Biết) Nhôm kim loại được tách ra tại cathode.
b. (Hiểu) Cryolite được thêm vào bể điện phân giúp tiết kiệm được năng lượng, giảm chi phí sản xuất.
c. (Vận dụng) Bên cạnh nhôm, oxygen tinh khiết cũng thu được trực tiếp từ quy trình này.
d. (Vận dụng) Vì anode và cathode đều làm bằng graphite, nên nếu đổi chiều dòng điện (anode trở thành cathode và ngược lại) thì quy trình điện phân vẫn xảy ra bình thường.
PHẦN III. Câu trắc nghiệm yêu cầu trả lời ngắn.
Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1. (Hiểu) Bao nhiêu gam chlorine ($Cl_2$) tác dụng vừa đủ với kim loại aluminium (Al) tạo ra 26,7 gam $AlCl_3$?
Câu 2. (Hiểu) Cho các cặp kim loại nguyên chất tiếp xúc trực tiếp với nhau: Fe và Pb; Fe và Zn; Fe và Sn; Fe và Ni. Khi nhúng các cặp kim loại trên vào dung dịch acid, số cặp kim loại trong đó Fe bị phá huỷ trước là bao nhiêu?
Câu 3. (Vận dụng) Thực hiện các thí nghiệm sau:
(a) Cho Mg dư vào dung dịch $FeCl_3$.
(b) Đốt dây Fe trong khí clo dư.
(c) Cho bột $Fe_3O_4$ vào dung dịch $H_2SO_4$ đặc, nóng, dư.
(d) Cho Fe vào dung dịch $AgNO_3$ dư.
(e) Cho bột Fe dư vào dung dịch $HNO_3$ loãng.
(f) Cho bột FeO vào dung dịch $KHSO_4$.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được muối iron (II) là bao nhiêu?
Câu 4. (Hiểu) Hòa tan hoàn toàn 3,22 gam hỗn hợp X gồm Fe, Mg và Zn bằng một lượng vừa đủ dung dịch $H_2SO_4$ loãng, thu được 1,4874 lít hiđro (ở đkc) và dung dịch chứa m gam muối. Giá trị của m bằng bao nhiêu? (làm tròn đến chữ số hàng trăm)
Câu 5. (Vận dụng) Điện phân 2 lít dung dịch NaCl 0,5 M với điện cực trơ, màng ngăn xốp bằng dòng điện có cường độ không đổi 0,2 A. Sau 1930 giây thì dừng điện phân, thu được dung dịch X (giả thiết thể tích dung dịch không đổi). Dung dịch X có pH bằng bao nhiêu? (làm tròn đến chữ số hàng chục).
Câu 6: (Hiểu) Cho 2,8 gam bột iron (Fe) vào 200 mL dung dịch gồm $AgNO_3$ 0,1M và $Cu(NO_3)_2$ 0,5M; khi các phản ứng xảy ra hoàn toàn thu được m gam chất rắn X. Giá trị của m bằng bao nhiêu? (làm tròn đến chữ số hàng trăm).

ThS. Lê Thị Mai Nhi
(Người kiểm duyệt, ra đề)
Chức vụ: Trưởng ban biên soạn môn Hoá Học THPT
Trình độ: Thạc sĩ Hóa học, Chứng chỉ hạng II, Chứng chỉ STEM, Ngoại ngữ B1
Kinh nghiệm: 10+ năm kinh nghiệm tại Trường THPT Chuyên Nguyễn Huệ

