Chọn đến phần học sinh cần nhanh chóng thông qua mục lục bằng cách click đến phần đó
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn.
Thí sinh trả lời từ câu 1 đến câu 20. Mỗi câu hỏi thí sinh chỉ chọn 1 phương án.
Câu 1: (biết)
Phát biểu nào sau đây về thứ tự điện phân trong dung dịch của các ion kim loại ở điện cực là đúng?
A. Ion kim loại ứng với thế điện cực chuẩn dương hơn sẽ được điện phân trước ở cực âm.
B. Ion kim loại ứng với thế điện cực chuẩn âm hơn sẽ được điện phân trước ở cực âm.
C. Ion kim loại ứng với thế điện cực chuẩn dương hơn sẽ được điện phân trước ở cực dương.
D. Ion kim loại ứng với thế điện cực chuẩn âm hơn sẽ được điện phân trước ở cực dương.
Câu 2: (biết)
Điện phân dung dịch hỗn hợp gồm HCl và $CuSO_4$ có cùng nồng độ. Các chất được tạo ra đầu tiên ở anode (cực dương) và ở cathode (cực âm) lần lượt là:
A. $Cl_2$ và $H_2$.
B. $Cl_2$ và Cu.
C. $O_2$ và Cu.
D. $O_2$ và $H_2$.
Câu 3: (biết)
Khi điện phân dung dịch NaCl có màng ngăn, các chất được tạo ra ở anode (cực dương) và cathode (cực âm) lần lượt là
A. $Cl_2$ và NaOH, $H_2$.
B. Na và $Cl_2$.
C. $Cl_2$ và Na.
D. NaOH và $H_2$.
Câu 4: (biết) Trong quá trình điện phân dung dịch $CuSO_4$ với anode bằng graphite, ở anode xảy ra quá trình
A. $2H_2O + 2e \to H_2 + 2 OH^-$
B. $2H_2O \to 4H^+ + O_2 + 4e$
C. $Cu^{2+} + 2e \to Cu$
D. $Cu \to Cu^{2+} + 2e$
Câu 5: (biết) Hình vẽ nào sau đây có thể được dùng để mô tả cấu trúc tinh thể kim loại?
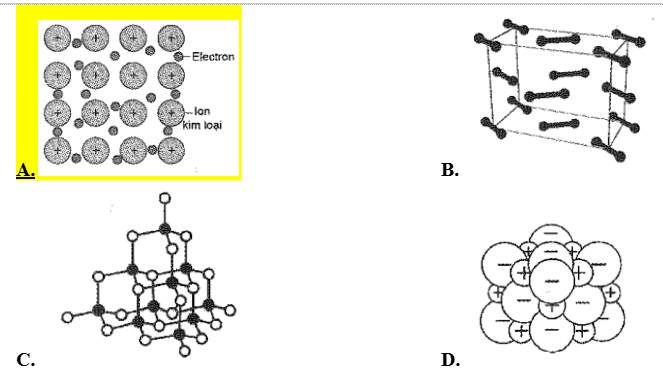
Câu 6: (biết) Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử X là $3s^1$. Số hiệu nguyên tử của nguyên tố X là
A. 11.
B. 12.
C. 13.
D. 14.
Câu 7: (biết) Nhóm những kim loại có độ dẫn điện tốt nhất là
A. Ag, Cu, Au.
B. Cu, Al, Hg.
C. Li, Na, K.
D. Fe, Cu, Zn.
Câu 9: (biết) Trong các phát biểu sau về tái chế nhôm, đồng, và sắt, đâu là phát biểu đúng?
A. Nhôm tái chế có chất lượng tương đương với nhôm nguyên chất ban đầu.
B. Sắt và thép không thể tái chế hoàn toàn.
C. Tái chế kim loại làm tăng phát thải khí nhà kính.
D. Tái chế kim loại luôn cần quá trình điện phân tốn nhiều năng lượng.
Câu 10: (biết) Trong vỏ Trái Đất, những kim loại nào sau đây tồn tại chủ yếu dưới dạng đơn chất.
A. Ag, Au.
B. Zn, Fe.
C. Mg, Al.
D. Na, Ba.
Câu 11: (biết) Trong công nghiệp, kim loại natri thường được điều chế bằng phương pháp nào sau đây?
A. Điện phân nóng chảy.
B. Điện phân dung dịch.
C. Nhiệt luyện.
D. Thủy luyện.
Câu 12: (biết) Trường hợp nào sau đây kim loại bị ăn mòn điện hoá học?
A. Đốt dây sắt trong khí oxygen khô.
B. Thép carbon để trong không khí ẩm.
C. Kim loại kẽm trong dung dịch HCl.
D. Kim loại sắt trong dung dịch $HNO_3$ loãng.
Câu 13: (biết) Để các hợp kim: Fe – Cu; Fe – C; Zn – Fe; Mg – Fe lâu ngày trong không khí ẩm. Số hợp kim mà trong đó Fe bị ăn mòn điện hoá là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 14: (hiểu) Thực hiện thí nghiệm sau:
Bước 1: Cho dung dịch NaCl 5% vào ống thuỷ tinh hình chữ U như hình bên.
Bước 2: Nhúng một thanh đồng và một thanh kẽm đã làm sạch vào hai đầu của ống U.
Bước 3: Nối hai thanh kim loại bằng dây dẫn.
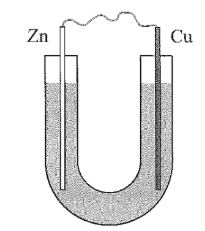
Sau bước 2, kim loại nào bị ăn mòn?
A. Đồng.
B. Cả hai đều bị ăn mòn.
C. Kẽm.
D. Không kim loại nào bị ăn mòn.
Câu 15: (vận dụng) Nhúng thanh kẽm và thanh đồng (không tiếp xúc với nhau) vào cốc đựng dung dịch $H_2SO_4$ loãng. Nối thanh kẽm và thanh đồng bằng dây dẫn (có một khóa X) như hình bên.
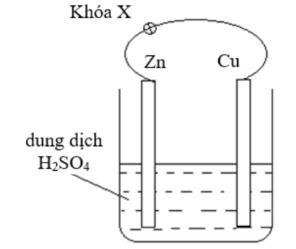
Cho các phát biểu sau:
(a) Khi thay dung dịch $H_2SO_4$ loãng bằng ethylic alcohol, thanh kẽm không bị ăn mòn.
(b) Khi đóng khóa X có bọt khí thoát ra ở thanh kẽm.
(c) Tốc độ bọt khí thoát ra khi mở khóa X và khi đóng khóa X là như nhau.
(d) Khi mở khóa X hay đóng khóa X, thanh Zn đều bị ăn mòn.
(e) Khi đóng khóa X có dòng electron chuyển dời từ thanh đồng sang thanh Zn.
(f) Khi đóng khóa X, thanh Zn đóng vai trò cực âm và bị oxi hóa.
(g) Khi thay thanh Cu bằng thanh Mg, thanh Zn vẫn bị ăn mòn điện hóa.
Số phát biểu đúng là
A. 5.
B. 2.
C. 4.
D. 3.
Câu 16: (vận dụng) Tiến hành các thí nghiệm sau:
(1) Cho Mg vào lượng dư dung dịch $FeCl_3$.
(2) Cho Ba vào lượng dư dung dịch $CuSO_4$.
(3) Cho Zn vào dung dịch $CuSO_4$.
(4) Cho dung dịch $Fe(NO_3)_2$ vào dung dịch $AgNO_3$.
Thí nghiệm nào thu được kim loại?
A. (3) và (4).
B. (1) và (2).
C. (2) và (3).
D. (1) và (4).
Câu 17: (vận dụng) Tiến hành điện phân dung dịch $CuSO_4$ theo sơ đồ điện phân sau:
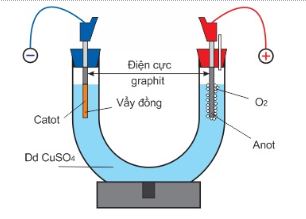
a. Thay dung dịch $CuSO_4$ bằng dung dịch $CuCl_2$ thì bản chất quá trình điện phân không thay đổi.
b. Điện phân một thời gian Cu bám trên cathode đồng thời anode tan ra.
c. Trong quá trình điện phân pH của dung dịch giảm.
d. Khi $CuSO_4$ bị điện phân hết sẽ có khí $H_2$ thoát ra bên anode.
Số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 18: (vận dụng)
Trong công nghiệp, nhôm (Al) được điều chế bằng cách điện phân nóng chảy hỗn hợp aluminium oxide ($Al_2O_3$) với cryolite ($Na_3AlF_6$) ở điện áp 5 V và cường độ dòng điện là 140 000 A. Xác định điện năng (theo MWh) đã tiêu thụ để sản xuất được 27 tấn nhôm. Cho biết hiệu suất sử dụng điện năng của quá trình điện phân là 90%. Điện năng $A = U \cdot q$ (q là điện lượng, 1 mol điện lượng = 96485 C, 1 MWh = $3,6 \cdot 10^9$ J)
A. 446,7 MWh
B. 223,4 MWh
C. 340,2 MWh
D. 402,0 MWh
PHẦN II. Câu hỏi trắc nghiệm đúng sai.
Thí sinh trả lời từ câu 1 đến câu 3. Trong mỗi ý a), b), c), d) ở mỗi câu thí sinh chọn đúng hoặc sai.
Câu 1:
Sơ đồ thể hiện thiết bị mạ một chiếc thìa bằng bạc
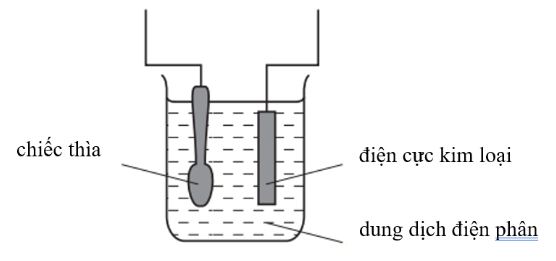
Cho các phát biểu sau:
(a) (hiểu) Bạc sẽ bám lên chiếc thìa bởi vì bạc là kim loại rất hoạt động.
(b) (hiểu) Dung dịch điện phân là một muối bạc tan tốt trong nước.
(c) (vận dụng) Điện cực kim loại được làm bằng bạc.
(d) (vận dụng) Chiếc thìa được nối với cực âm của nguồn điện.
Câu 2:
Thả một đinh sắt nặng $m_1$ gam đã được đánh sạch bề mặt vào cốc chứa dung dịch copper(II) sulfate màu xanh. Sau một thời gian thấy toàn bộ lượng đồng sinh ra đã bám vào “đinh sắt” (thực chất là phần đinh sắt chưa phản ứng). Lấy “đinh sắt” ra khỏi cốc dung dịch, sấy khô, đem cân được $m_2$ gam.
Mỗi phát biểu sau đây là đúng hay sai?
(a) (hiểu) Phản ứng diễn ra là: $2Fe(s) + 3Cu^{2+} (aq) \to 2Fe^{3+} (aq) + 3Cu(s)$.
(b) (hiểu) Màu xanh của dung dịch copper(II) sulfate nhạt dần.
(c) (vận dụng) So sánh, thu được kết quả $m_2 < m_1$.
(d) (vận dụng) Nếu thay đinh sắt ban đầu bằng thanh kẽm thì màu xanh của dung dịch không thay đổi.
Câu 3:
Thực hiện thí nghiệm sau:
Bước 1: Cho dung dịch NaCl 5% vào ống thuỷ tinh hình chữ U như hình bên.
Bước 2: Nhúng một thanh đồng và một thanh kẽm đã làm sạch vào hai đầu của ống chữ U.
Bước 3: Nối hai thanh kim loại bằng dây dẫn.
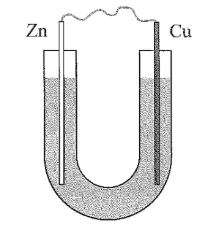
Sau bước 3:
(a) (biết) Hai kim loại kẽm và đồng đều bị ăn mòn.
(b) (hiểu) Kẽm bị oxi hoá và đóng vai trò là anode.
(c) (hiểu) $Cu^{2+}$ bị khử thành Cu bám vào thanh đồng, làm khối lượng thanh đồng tăng dần.
(d) (vận dụng) Khoảng vài phút sau bước 3, nhỏ vài giọt phenolphthalein vào dung dịch gần thanh đồng và quan sát thấy dung dịch dần chuyển sang màu hồng.
Câu 4: Thực tế công nghiệp trong quá trình sản xuất và khai thác các kim loại phổ biến như Au, Al, Cu, Fe:
(a) (biết) Kim loại Al được điều chế bằng phương pháp điện phân nóng chảy quặng boxit, còn Fe được điều chế bằng phương pháp điện phân dung dịch muối sắt.
(b) (hiểu) Kim loại Fe được điều chế dễ dàng hơn nhôm vì nhôm cần phương pháp nhiệt luyện trong lò cao, còn Fe điều chế bằng điện phân nóng chảy.
(c) (hiểu) Kim loại Au thường tồn tại ở dạng tự do trong tự nhiên, trong khi Cu thường tồn tại dưới dạng hợp chất và cần dùng phương pháp thủy luyện để tách ra.
(d) (vận dụng) Kim loại Cu có thể được điều chế bằng phương pháp nhiệt luyện hoặc thủy luyện, còn Au có thể được tách ra từ quặng bằng phương pháp thủy luyện hoặc điện phân.
PHẦN III. Câu trắc nghiệm yêu cầu trả lời ngắn.
Thí sinh trả lời từ câu 1 đến câu 4.
Câu 1: (hiểu)
Cho các kim loại : Na, Zn, Cu, Fe và các dung dịch muối : NaCl, $Cu(NO_3)_2$, $FeCl_2$, $Zn(NO_3)_2$. Cho từng kim loại phản ứng lần lượt với từng dung dịch muối, có bao nhiêu cặp phản ứng thu được sản phẩm là kim loại?
Câu 2: (hiểu) Trong quy trình Kroll, 1 tấn quặng ilmenit chứa 55% $TiO_2$ và các tạp chất khác. Sau khi loại bỏ các tạp chất, phần $TiO_2$ được phản ứng với chlorine để tạo ra $TiCl_4$, sau đó được khử bằng natri để tạo ra titanium kim loại theo phản ứng:
$TiCl_4(aq) + 4Na (s) \to Ti (s) + 4NaCl (s)$
Biết rằng hiệu suất của quá trình phản ứng giữa $TiO_2$ và chlorine và quá trình khử $TiCl_4$ bằng sodium lần lượt là 90% và 85%. Khối lượng titanium (kg) thu được từ 1 tấn quặng ilmenit là bao nhiêu? Làm tròn đến số nguyên gần nhất.
Khối lượng mol của các chất: $TiO_2$: 79.87 g/mol, $TiCl_4$: 189.71 g/mol, Na: 22.99 g/mol, Ti: 47.87 g/mol.
Câu 3: (vận dụng)
Một nhà máy cần mạ một lớp kẽm lên một tấm thép để chống ăn mòn. Tấm thép có diện tích 0,5 mét vuông và yêu cầu lớp kẽm có độ dày 75 micromet ($\mu m$). Dung dịch điện phân sử dụng là $ZnSO_4$ và cường độ dòng điện là 6 ampe. Khối lượng riêng của kẽm là 7.140 $kg/m^3$, hằng số Faraday F=96.485 C/mol. Khối lượng kẽm dư thừa là bao nhiêu gam nếu hiệu suất thực tế của quá trình mạ không đạt yêu cầu và lớp mạ thực tế chỉ đạt độ dày 60 $\mu m$. Làm tròn kết quả đến phần mười.
Câu 4: (hiểu)
Cho các phát biểu về ứng dụng của quá trình điện phân vào thực tế như mạ, tinh chế kim loại, và sản xuất kim loại:
(a) Mạ điện giúp phủ một lớp kim loại lên bề mặt kim loại khác để tăng độ bền hoặc thẩm mỹ.
(b) Tinh chế kim loại bằng điện phân chỉ được áp dụng cho các kim loại có giá trị cao như vàng và bạc.
(c) Sản xuất nhôm, một kim loại nhẹ, chủ yếu dựa vào phương pháp điện phân aluminium oxide trong cryolite để giảm tiêu thụ năng lượng.
(d) Điện phân là phương pháp duy nhất để sản xuất kim loại từ quặng.
(e) Điện phân là phương pháp phổ biến để sản xuất kim loại từ quặng, đặc biệt là với những kim loại không thể chiết tách bằng phương pháp nhiệt luyện hoặc thủy luyện.
Có bao nhiêu phát biểu đúng?
Câu 5. (hiểu) Vàng (Au) đơn chất tồn tại trong tự nhiên ở trong quặng vàng thường có hàm lượng vàng thấp. Để thu hồi vàng từ quặng vàng, người ta nghiền quặng, hòa tan chúng vào dung dịch KCN và liên tục sục không khí vào. Vàng bị hòa tan tạo thành phức chất:
$4Au(s) + 8KCN(aq) + O_2(g) + 2H_2O(l) \to 4K[Au(CN)_2](aq) + 4KOH(aq)$ (1)
và sau đó kết tủa vàng bằng kẽm (Zn):
$Zn(s) + 2K[Au(CN)_2](aq) \to K_2[Zn(CN)_4](aq) + 2Au(s)$ (2)
Nếu dùng 13 kg KCN thì có thể tách được bao nhiêu kg vàng từ quặng theo chuỗi phản ứng trên? Giả thiết các chất khác trong quặng không phản ứng với KCN. Làm tròn kết quả đến phần chục.
Câu 6. (hiểu) Một thanh Mg nặng 6,0 kg được gắn vào một đường ống bằng thép chôn dưới đất sét ẩm để chống ăn mòn cho đường ống. Khi đó sẽ xuất hiện một dòng điện (gọi là dòng bảo vệ) có cường độ 0,03 A chạy giữa thanh Mg và đường ống. Điện lượng (q) của pin điện hóa được xác định bởi biểu thức $q= I \cdot t = n_e \cdot F$. Trong đó: I là cường độ dòng điện (A); t là thời gian pin hoạt động (giây); F là hằng số Faraday, $F = 96500 C/mol$, $n_e$ là số mol e trao đổi giữa hai điện cực. Biết hiệu suất bảo vệ đối với Mg là 50%. Khoảng thời gian đường ống có thể được bảo vệ bởi thanh Mg khỏi các quá trình ăn mòn kim loại là bao nhiêu năm? Làm tròn kết quả đến phần mười.

.jpg?alt=media&token=bd9ea895-272b-46c5-94c1-769867efa052)