Chọn đến phần học sinh cần nhanh chóng thông qua mục lục bằng cách click đến phần đó
- I. GIỚI THIỆU VỀ ĐIỆN PHÂN
- 1. Điện phân là gì?
- 2. Các đại lượng cơ bản trong điện phân
- II. CÔNG THỨC FARADAY – NỀN TẢNG
- 1. Định luật Faraday thứ nhất – Công thức điện lượng
- 2. Số mol electron trao đổi
- 3. Khối lượng chất giải phóng ở điện cực
- 4. Thể tích khí (ở điều kiện chuẩn)
- III. CÔNG THỨC TÍNH THỜI GIAN ĐIỆN PHÂN
- 1. Tính thời gian từ điện lượng
- 2. Tính thời gian từ số mol electron
- 3. Tính thời gian từ khối lượng chất
- 4. Tính thời gian từ thể tích khí
- IV. CÁC TRƯỜNG HỢP ĐIỆN PHÂN ĐẶC BIỆT
- 1. Điện phân nước (dung dịch H₂SO₄ loãng hoặc NaOH loãng)
- 2. Điện phân dung dịch muối (có kim loại giải phóng)
- 3. Điện phân NaCl nóng chảy
- 4. Điện phân dung dịch NaCl (có màng ngăn)
- V. BẢNG CÔNG THỨC TỔNG HỢP
- A. Công thức cơ bản (CẦN NHỚ)
- B. Công thức điện phân nước
- C. Số electron (n) trong các phản ứng thường gặp
- VI. PHƯƠNG PHÁP GIẢI BÀI TẬP
- Quy trình 4 bước giải bài tập điện phân
- VII. BÀI TẬP MẪU
- VIII. MẸO VÀ LƯU Ý
- 1. Mẹo nhớ công thức
- 2. Các sai lầm thường gặp
- 3. Lưu ý quan trọng
- IX. KẾT LUẬN
- Lời khuyên học tập
I. GIỚI THIỆU VỀ ĐIỆN PHÂN
1. Điện phân là gì?
Định nghĩa: Điện phân là quá trình oxy hóa – khử xảy ra khi có dòng điện một chiều chạy qua dung dịch chất điện ly hoặc chất điện ly nóng chảy.
Bản chất:
- Sử dụng năng lượng điện để thực hiện phản ứng hóa học không tự xảy ra
- Biến đổi năng lượng điện thành năng lượng hóa học
- Là quá trình oxy hóa – khử xảy ra tại hai điện cực
Thiết bị điện phân gồm:
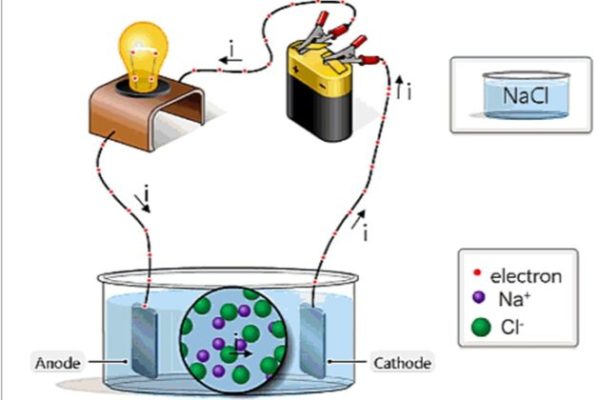
- Bình điện phân: Chứa dung dịch hoặc chất nóng chảy cần điện phân
- Nguồn điện một chiều: Cung cấp dòng điện
- Điện cực:
- Catot (-): Cực âm, nơi xảy ra quá trình khử (nhận electron)
- Anot (+): Cực dương, nơi xảy ra quá trình oxi hóa (nhường electron)
2. Các đại lượng cơ bản trong điện phân
| Đại lượng | Ký hiệu | Đơn vị | Ý nghĩa |
|---|---|---|---|
| Cường độ dòng điện | I | A (Ampe) | Dòng điện chạy qua bình điện phân |
| Thời gian | t | s (giây) | Thời gian thực hiện điện phân |
| Điện lượng | Q | C (Coulomb) | Lượng điện tích qua bình |
| Số mol electron | n(e) | mol | Số mol electron trao đổi |
| Khối lượng | m | g (gam) | Khối lượng chất giải phóng |
| Thể tích khí | V | lít | Thể tích khí thoát ra |
| Hằng số Faraday | F | C/mol | F = 96500 C/mol |
Lưu ý quan trọng về đơn vị:
- Thời gian phải đổi về giây (s): 1 phút = 60s, 1 giờ = 3600s
- Thể tích khí thường tính ở điều kiện chuẩn (đktc)
- Khối lượng mol nguyên tử (A) tính bằng g/mol
II. CÔNG THỨC FARADAY – NỀN TẢNG
1. Định luật Faraday thứ nhất – Công thức điện lượng
📌 Công thức:
$$\boxed{Q = I \times t}$$
Trong đó:
- Q: Điện lượng (Coulomb – C)
- I: Cường độ dòng điện (Ampe – A)
- t: Thời gian điện phân (giây – s)
Ý nghĩa: Điện lượng tỷ lệ thuận với cường độ dòng điện và thời gian điện phân.
Ví dụ 1: Điện phân với dòng điện I = 5A trong thời gian 2 giờ. Tính điện lượng?
Lời giải:
- Đổi thời gian: t = 2 giờ = 2 × 3600 = 7200 giây
- Áp dụng công thức: $$Q = I \times t = 5 \times 7200 = 36000 \text{ C}$$
Kết luận: Điện lượng là 36000 Coulomb.
2. Số mol electron trao đổi
📌 Công thức quan trọng nhất:
$$\boxed{n(e) = \frac{Q}{F} = \frac{I \times t}{F}}$$
Trong đó:
- n(e): Số mol electron trao đổi (mol)
- Q: Điện lượng (C)
- F: Hằng số Faraday = 96500 C/mol ≈ 96487 C/mol
- I: Cường độ dòng điện (A)
- t: Thời gian (s)
Ý nghĩa hằng số Faraday:
- 1 mol electron mang điện tích bằng 96500 Coulomb
- F = 96500 C/mol là hằng số cần nhớ trong mọi bài tập điện phân
Ví dụ 2: Với điện lượng Q = 19300 C, tính số mol electron?
Lời giải: $$n(e) = \frac{Q}{F} = \frac{19300}{96500} = 0.2 \text{ mol}$$
Kết luận: Có 0.2 mol electron trao đổi.
Ví dụ 3: Điện phân với I = 10A trong 965 giây. Tính số mol electron?
Lời giải: $$n(e) = \frac{I \times t}{F} = \frac{10 \times 965}{96500} = \frac{9650}{96500} = 0.1 \text{ mol}$$
Kết luận: Số mol electron là 0.1 mol.
3. Khối lượng chất giải phóng ở điện cực
📌 Định luật Faraday thứ hai:
$$\boxed{m = \frac{A \times I \times t}{n \times F}}$$
Hoặc có thể viết:
$$\boxed{m = \frac{A \times Q}{n \times F} = \frac{A \times n(e)}{n}}$$
Trong đó:
- m: Khối lượng chất giải phóng (g)
- A: Khối lượng mol nguyên tử (g/mol)
- n: Số electron trao đổi trong phản ứng (electron/nguyên tử)
- I: Cường độ dòng điện (A)
- t: Thời gian (s)
- F: Hằng số Faraday = 96500 C/mol
Cách xác định số electron n:
- Cu²⁺ + 2e → Cu: n = 2
- Al³⁺ + 3e → Al: n = 3
- Ag⁺ + e → Ag: n = 1
- Na⁺ + e → Na: n = 1
Ví dụ 4: Điện phân dung dịch CuSO₄ với I = 10A trong 1930 giây. Tính khối lượng Cu bám vào catot? (Cho Cu = 64)
Lời giải:
Bước 1: Viết phương trình điện cực
- Tại catot (-): Cu²⁺ + 2e → Cu
- Số electron: n = 2
Bước 2: Áp dụng công thức $$m_{Cu} = \frac{A \times I \times t}{n \times F} = \frac{64 \times 10 \times 1930}{2 \times 96500}$$
$$= \frac{1235200}{193000} = 6.4 \text{ g}$$
Kết luận: Khối lượng Cu bám vào catot là 6.4 gam.
4. Thể tích khí (ở điều kiện chuẩn)
📌 Công thức thể tích khí:
$$\boxed{V = \frac{22.4 \times I \times t}{n \times F}}$$
Hoặc:
$$\boxed{V = 22.4 \times n(\text{khí}) = \frac{22.4 \times n(e)}{n}}$$
Trong đó:
- V: Thể tích khí ở điều kiện chuẩn (lít)
- 22.4: Thể tích mol khí ở đktc (lít/mol)
- n: Số electron trong phản ứng tạo khí
- n(e): Số mol electron trao đổi
Các giá trị n thường gặp:
- 2H₂O + 2e → H₂ + 2OH⁻: n = 2 (tạo H₂)
- 4OH⁻ → O₂ + 2H₂O + 4e: n = 4 (tạo O₂)
- 2Cl⁻ → Cl₂ + 2e: n = 2 (tạo Cl₂)
Ví dụ 5: Điện phân nước, ở anot thoát khí O₂. Biết n(e) = 0.4 mol. Tính thể tích O₂ thu được ở đktc?
Lời giải:
Bước 1: Viết phương trình anot
- 4OH⁻ → O₂ + 2H₂O + 4e
- Số electron để tạo 1 mol O₂: n = 4
Bước 2: Tính thể tích $$V_{O_2} = \frac{22.4 \times n(e)}{n} = \frac{22.4 \times 0.4}{4} = \frac{8.96}{4} = 2.24 \text{ lít}$$
Kết luận: Thể tích O₂ là 2.24 lít ở đktc.
III. CÔNG THỨC TÍNH THỜI GIAN ĐIỆN PHÂN
Từ các công thức gốc, ta có thể suy ra công thức tính thời gian điện phân trong nhiều trường hợp khác nhau.
1. Tính thời gian từ điện lượng
Từ công thức: Q = I × t
Suy ra:
$$\boxed{t = \frac{Q}{I}}$$
Đơn vị: t (giây), Q (Coulomb), I (Ampe)
2. Tính thời gian từ số mol electron
Từ công thức: $n(e) = \frac{I \times t}{F}$
Suy ra:
$$\boxed{t = \frac{n(e) \times F}{I} = \frac{n(e) \times 96500}{I}}$$
Đơn vị: t (giây), n(e) (mol), I (Ampe)
3. Tính thời gian từ khối lượng chất
Từ công thức: $m = \frac{A \times I \times t}{n \times F}$
Suy ra:
$$\boxed{t = \frac{m \times n \times F}{A \times I} = \frac{m \times n \times 96500}{A \times I}}$$
Đơn vị: t (giây), m (gam), A (g/mol), I (Ampe)
4. Tính thời gian từ thể tích khí
Từ công thức: $V = \frac{22.4 \times I \times t}{n \times F}$
Suy ra:
$$\boxed{t = \frac{V \times n \times F}{22.4 \times I} = \frac{V \times n \times 96500}{22.4 \times I}}$$
Đơn vị: t (giây), V (lít ở đktc), I (Ampe)
Ví dụ 6: Muốn thu được 11.2 lít khí H₂ (đktc) từ điện phân nước với dòng điện I = 10A. Tính thời gian điện phân?
Lời giải:
Bước 1: Viết phương trình điện phân nước $$2H_2O \xrightarrow{\text{đp}} 2H_2 + O_2$$
Tại catot: 2H₂O + 2e → H₂ + 2OH⁻ (n = 2)
Bước 2: Tính số mol H₂ $$n(H_2) = \frac{V}{22.4} = \frac{11.2}{22.4} = 0.5 \text{ mol}$$
Bước 3: Tính số mol electron $$n(e) = n \times n(H_2) = 2 \times 0.5 = 1 \text{ mol}$$
Bước 4: Tính thời gian $$t = \frac{n(e) \times F}{I} = \frac{1 \times 96500}{10} = 9650 \text{ giây}$$
Đổi sang phút: $t = \frac{9650}{60} = 160.83$ phút ≈ 2.68 giờ
Kết luận: Thời gian điện phân là 9650 giây ≈ 161 phút ≈ 2.7 giờ.
IV. CÁC TRƯỜNG HỢP ĐIỆN PHÂN ĐẶC BIỆT
1. Điện phân nước (dung dịch H₂SO₄ loãng hoặc NaOH loãng)
Phương trình tổng quát: $$2H_2O \xrightarrow{\text{điện phân}} 2H_2 + O_2$$
Tại catot (-): Quá trình khử
$$2H_2O + 2e \rightarrow H_2 + 2OH^-$$
- Nước nhận electron tạo H₂
- Số electron: n = 2
Tại anot (+): Quá trình oxi hóa
$$4OH^- \rightarrow O_2 + 2H_2O + 4e$$
- Ion OH⁻ nhường electron tạo O₂
- Số electron: n = 4
📌 Công thức thể tích khí:
Thể tích H₂ (ở catot): $$V_{H_2} = \frac{22.4 \times I \times t}{2F} = \frac{11.2 \times I \times t}{F}$$
Thể tích O₂ (ở anot): $$V_{O_2} = \frac{22.4 \times I \times t}{4F} = \frac{5.6 \times I \times t}{F}$$
Tỉ lệ thể tích: $$\boxed{V_{H_2} : V_{O_2} = 2:1}$$
Ví dụ 7: Điện phân nước với I = 5A trong 3860 giây. Tính thể tích H₂ và O₂ thu được ở đktc?
Lời giải:
Bước 1: Tính số mol electron $$n(e) = \frac{I \times t}{F} = \frac{5 \times 3860}{96500} = \frac{19300}{96500} = 0.2 \text{ mol}$$
Bước 2: Tính thể tích H₂
- Tại catot: 2H₂O + 2e → H₂ → n = 2 $$V_{H_2} = \frac{n(e)}{2} \times 22.4 = \frac{0.2}{2} \times 22.4 = 0.1 \times 22.4 = 2.24 \text{ lít}$$
Bước 3: Tính thể tích O₂
- Tại anot: 4OH⁻ → O₂ + 2H₂O + 4e → n = 4 $$V_{O_2} = \frac{n(e)}{4} \times 22.4 = \frac{0.2}{4} \times 22.4 = 0.05 \times 22.4 = 1.12 \text{ lít}$$
Kiểm tra: $V_{H_2} : V_{O_2} = 2.24 : 1.12 = 2:1$ ✓
Kết luận:
- Thể tích H₂: 2.24 lít
- Thể tích O₂: 1.12 lít
2. Điện phân dung dịch muối (có kim loại giải phóng)
Ví dụ: Điện phân dung dịch CuSO₄
Tại catot (-): $$Cu^{2+} + 2e \rightarrow Cu$$
- Ion Cu²⁺ nhận electron, khử thành Cu kim loại
- Cu bám vào catot
Khối lượng Cu bám vào catot: $$m_{Cu} = \frac{64 \times I \times t}{2 \times 96500} = \frac{32 \times I \times t}{96500}$$
Tại anot (+):
Trường hợp 1: Anot trơ (Pt, C, than chì) $$2H_2O \rightarrow O_2 + 4H^+ + 4e$$
- Nước bị oxi hóa, tạo O₂
Trường hợp 2: Anot tan (Cu, Ag, Ni) $$Cu \rightarrow Cu^{2+} + 2e$$
- Điện cực Cu bị hòa tan, tạo ion Cu²⁺
3. Điện phân NaCl nóng chảy
Phương trình tổng: $$2NaCl \xrightarrow{\text{đp, nóng chảy}} 2Na + Cl_2$$
Tại catot (-): $$Na^+ + e \rightarrow Na$$
- n = 1
Tại anot (+): $$2Cl^- \rightarrow Cl_2 + 2e$$
- n = 2
Công thức:
- Khối lượng Na: $m_{Na} = \frac{23 \times I \times t}{96500}$
- Thể tích Cl₂: $V_{Cl_2} = \frac{11.2 \times I \times t}{96500}$
4. Điện phân dung dịch NaCl (có màng ngăn)
Sản phẩm điện phân:
- Catot (-): Khí H₂ và dung dịch NaOH
- Anot (+): Khí Cl₂
Phương trình tổng: $$2NaCl + 2H_2O \xrightarrow{\text{đp, màng ngăn}} 2NaOH + Cl_2 + H_2$$
Ứng dụng: Công nghiệp sản xuất NaOH (xút) và Cl₂ từ muối ăn.
Lưu ý: Cần có màng ngăn để tránh NaOH tác dụng với Cl₂: $$2NaOH + Cl_2 \rightarrow NaCl + NaClO + H_2O$$
V. BẢNG CÔNG THỨC TỔNG HỢP
A. Công thức cơ bản (CẦN NHỚ)
| Công thức | Biểu thức | Đơn vị |
|---|---|---|
| Điện lượng | $Q = I \times t$ | C (Coulomb) |
| Số mol electron | $n(e) = \frac{Q}{F} = \frac{I \times t}{F}$ | mol |
| Khối lượng chất | $m = \frac{A \times I \times t}{n \times F}$ | g (gam) |
| Thể tích khí (đktc) | $V = \frac{22.4 \times I \times t}{n \times F}$ | lít |
| Thời gian | $t = \frac{Q}{I} = \frac{n(e) \times F}{I}$ | s (giây) |
Hằng số Faraday cần nhớ:
$$\boxed{F = 96500 \text{ C/mol}}$$
B. Công thức điện phân nước
| Chất | Vị trí | Công thức thể tích | Số mol |
|---|---|---|---|
| H₂ | Catot (-) | $V = \frac{11.2 \times I \times t}{F}$ | $n = \frac{n(e)}{2}$ |
| O₂ | Anot (+) | $V = \frac{5.6 \times I \times t}{F}$ | $n = \frac{n(e)}{4}$ |
Tỉ lệ thể tích: $$\boxed{V_{H_2} : V_{O_2} = 2:1}$$
C. Số electron (n) trong các phản ứng thường gặp
| Phản ứng điện cực | n | Ứng dụng |
|---|---|---|
| Cu²⁺ + 2e → Cu | 2 | Điện phân CuSO₄ |
| Al³⁺ + 3e → Al | 3 | Điện phân Al₂O₃ nóng chảy |
| Ag⁺ + e → Ag | 1 | Mạ bạc |
| Na⁺ + e → Na | 1 | Điện phân NaCl nóng chảy |
| 2H₂O + 2e → H₂ + 2OH⁻ | 2 | Catot (điện phân nước) |
| 4OH⁻ → O₂ + 2H₂O + 4e | 4 | Anot (điện phân nước) |
| 2Cl⁻ → Cl₂ + 2e | 2 | Anot (điện phân NaCl) |
| Zn²⁺ + 2e → Zn | 2 | Mạ kẽm |
| Ni²⁺ + 2e → Ni | 2 | Mạ niken |
VI. PHƯƠNG PHÁP GIẢI BÀI TẬP
Quy trình 4 bước giải bài tập điện phân
Bước 1: Viết phương trình điện phân
- Xác định các quá trình tại catot (-) và anot (+)
- Xác định số electron trao đổi (n) trong mỗi phản ứng
- Chú ý phân biệt anot trơ và anot tan
Ví dụ: Điện phân CuSO₄ với anot trơ
- Catot: Cu²⁺ + 2e → Cu (n = 2)
- Anot: 2H₂O → O₂ + 4H⁺ + 4e (n = 4)
Bước 2: Tính điện lượng hoặc số mol electron
Công thức: $$Q = I \times t$$ $$n(e) = \frac{I \times t}{F} = \frac{I \times t}{96500}$$
Lưu ý: Đổi thời gian về giây nếu đề cho phút hoặc giờ
Bước 3: Tính đại lượng cần tìm
Tính khối lượng: $$m = \frac{A \times n(e)}{n}$$
Tính thể tích khí: $$V = \frac{22.4 \times n(e)}{n}$$
Tính số mol chất: $$n_{\text{chất}} = \frac{n(e)}{n}$$
Bước 4: Kiểm tra kết quả
- Đơn vị có đúng không?
- Kết quả có hợp lý về mặt số liệu không?
- Có thỏa mãn tỉ lệ không? (Ví dụ: $V_{H_2}:V_{O_2} = 2:1$)
VII. BÀI TẬP MẪU
Bài 1: Tính khối lượng kim loại bám vào catot
Đề bài: Điện phân dung dịch AgNO₃ với cường độ dòng điện I = 5A trong thời gian 1930 giây. Tính khối lượng Ag bám vào catot? (Cho: Ag = 108)
Lời giải:
Bước 1: Viết phương trình điện cực
- Tại catot: Ag⁺ + e → Ag
- Số electron: n = 1
Bước 2: Áp dụng công thức $$m_{Ag} = \frac{A \times I \times t}{n \times F} = \frac{108 \times 5 \times 1930}{1 \times 96500}$$
$$= \frac{1042200}{96500} = 10.8 \text{ g}$$
Kết luận: Khối lượng Ag bám vào catot là 10.8 gam.
Bài 2: Điện phân nước
Đề bài: Điện phân nước (có H₂SO₄ loãng làm chất điện ly) với cường độ dòng điện I = 10A trong thời gian 16 phút 5 giây. Tính thể tích khí H₂ và O₂ thu được ở điều kiện chuẩn?
Lời giải:
Bước 1: Đổi thời gian về giây $$t = 16 \times 60 + 5 = 960 + 5 = 965 \text{ giây}$$
Bước 2: Tính số mol electron $$n(e) = \frac{I \times t}{F} = \frac{10 \times 965}{96500} = \frac{9650}{96500} = 0.1 \text{ mol}$$
Bước 3: Tính thể tích H₂
- Catot: 2H₂O + 2e → H₂ + 2OH⁻ (n = 2) $$n(H_2) = \frac{n(e)}{2} = \frac{0.1}{2} = 0.05 \text{ mol}$$ $$V_{H_2} = 0.05 \times 22.4 = 1.12 \text{ lít}$$
Bước 4: Tính thể tích O₂
- Anot: 4OH⁻ → O₂ + 2H₂O + 4e (n = 4) $$n(O_2) = \frac{n(e)}{4} = \frac{0.1}{4} = 0.025 \text{ mol}$$ $$V_{O_2} = 0.025 \times 22.4 = 0.56 \text{ lít}$$
Kiểm tra: $\frac{V_{H_2}}{V_{O_2}} = \frac{1.12}{0.56} = 2$ ✓
Kết luận:
- Thể tích H₂: 1.12 lít
- Thể tích O₂: 0.56 lít
Bài 3: Tính thời gian điện phân
Đề bài: Muốn thu được 6.4 gam Cu từ dung dịch CuSO₄ với cường độ dòng điện I = 5A. Tính thời gian điện phân cần thiết? (Cho: Cu = 64)
Lời giải:
Bước 1: Viết phương trình
- Catot: Cu²⁺ + 2e → Cu
- Số electron: n = 2
Bước 2: Tính số mol Cu $$n(Cu) = \frac{m}{A} = \frac{6.4}{64} = 0.1 \text{ mol}$$
Bước 3: Tính số mol electron $$n(e) = n \times n(Cu) = 2 \times 0.1 = 0.2 \text{ mol}$$
Bước 4: Tính thời gian $$t = \frac{n(e) \times F}{I} = \frac{0.2 \times 96500}{5} = \frac{19300}{5} = 3860 \text{ giây}$$
Đổi sang phút: $t = \frac{3860}{60} = 64.33$ phút ≈ 64 phút 20 giây
Kết luận: Thời gian điện phân là 3860 giây ≈ 64.3 phút.
Bài 4: Điện phân dung dịch hỗn hợp
Đề bài: Điện phân dung dịch chứa CuSO₄ và NaCl với catot trơ, anot trơ. Cường độ dòng điện I = 10A, thời gian t = 1930 giây. Tính khối lượng Cu bám vào catot và thể tích Cl₂ thoát ra ở anot (đktc)? (Cho: Cu = 64)
Lời giải:
Bước 1: Viết phương trình điện cực
- Catot: Cu²⁺ + 2e → Cu (n = 2)
- Anot: 2Cl⁻ → Cl₂ + 2e (n = 2)
Bước 2: Tính số mol electron $$n(e) = \frac{I \times t}{F} = \frac{10 \times 1930}{96500} = \frac{19300}{96500} = 0.2 \text{ mol}$$
Bước 3: Tính khối lượng Cu $$m_{Cu} = \frac{A \times n(e)}{n} = \frac{64 \times 0.2}{2} = \frac{12.8}{2} = 6.4 \text{ g}$$
Bước 4: Tính thể tích Cl₂ $$V_{Cl_2} = \frac{22.4 \times n(e)}{n} = \frac{22.4 \times 0.2}{2} = \frac{4.48}{2} = 2.24 \text{ lít}$$
Kết luận:
- Khối lượng Cu: 6.4 gam
- Thể tích Cl₂: 2.24 lít (đktc)
VIII. MẸO VÀ LƯU Ý
1. Mẹo nhớ công thức
Công thức trung tâm – NỀN TẢNG:
$$\boxed{n(e) = \frac{I \times t}{F}}$$
Từ công thức này, suy ra tất cả các công thức khác!
Hằng số Faraday – CẦN NHỚ:
$$\boxed{F = 96500 \text{ C/mol}}$$
Mẹo nhớ:
- Gần 100000 (nhưng là 96500)
- Nhớ: “96 nghìn rưỡi” = 96500
- Trong đề bài thường cho: F = 96500 C/mol
Số electron n trong phản ứng:
Nguyên tắc: Số electron = hóa trị kim loại
| Ion | Phản ứng | n |
|---|---|---|
| Cu²⁺ | Cu²⁺ + 2e → Cu | 2 |
| Al³⁺ | Al³⁺ + 3e → Al | 3 |
| Ag⁺ | Ag⁺ + e → Ag | 1 |
| Na⁺ | Na⁺ + e → Na | 1 |
| Fe³⁺ | Fe³⁺ + 3e → Fe | 3 |
Khí:
- H₂: n = 2
- O₂: n = 4
- Cl₂: n = 2
2. Các sai lầm thường gặp
❌ SAI LẦM 1: Quên đổi thời gian sang giây
Sai:
- Cho t = 2 giờ → tính luôn t = 2 ❌
Đúng:
- t = 2 giờ = 2 × 3600 = 7200 giây ✓
Bảng đổi đơn vị:
- 1 phút = 60 giây
- 1 giờ = 60 phút = 3600 giây
- 1 giờ 30 phút = 5400 giây
❌ SAI LẦM 2: Nhầm số electron n trong phản ứng
Sai:
- Cu²⁺ + e → Cu (n = 1) ❌
Đúng:
- Cu²⁺ + 2e → Cu (n = 2) ✓
Cách kiểm tra: Số electron = điện tích ion = hóa trị
❌ SAI LẦM 3: Quên hằng số Faraday
Sai:
- $n(e) = \frac{I \times t}{100000}$ ❌
Đúng:
- $n(e) = \frac{I \times t}{96500}$ ✓
❌ SAI LẦM 4: Nhầm catot (-) và anot (+)
Cần nhớ:
- Catot (-): Cực âm → Quá trình khử → Nhận electron → Kim loại bám vào
- Anot (+): Cực dương → Quá trình oxi hóa → Nhường electron → Khí thoát ra
3. Lưu ý quan trọng
Về điện cực:
Catot (-): Quá trình khử
- Thu electron
- Kim loại bám vào điện cực
- Khí H₂ thoát ra (nếu không có kim loại)
Anot (+): Quá trình oxi hóa
- Nhường electron
- Khí thoát ra (O₂, Cl₂…)
- Điện cực tan (nếu là anot tan)
Về tỉ lệ thể tích:
Điện phân nước: $$\boxed{V_{H_2} : V_{O_2} = 2:1}$$
Luôn kiểm tra tỉ lệ này để xác nhận kết quả đúng!
Về đơn vị:
- Cường độ dòng điện: A (Ampe)
- Thời gian: s (giây) – phải đổi!
- Điện lượng: C (Coulomb)
- Khối lượng: g (gam)
- Thể tích khí: lít (ở đktc)
IX. KẾT LUẬN
Bài viết đã trình bày đầy đủ và chi tiết các công thức điện phân theo định luật Faraday:
Công thức nền tảng – QUAN TRỌNG NHẤT: $$\boxed{n(e) = \frac{I \times t}{F}}$$
Các công thức ứng dụng:
- Khối lượng: $m = \frac{A \times I \times t}{n \times F}$
- Thể tích khí: $V = \frac{22.4 \times I \times t}{n \times F}$
- Thời gian: $t = \frac{n(e) \times F}{I}$
- Điện lượng: $Q = I \times t$
Hằng số cần nhớ: $$\boxed{F = 96500 \text{ C/mol}}$$
Lời khuyên học tập
Học thuộc hằng số Faraday: F = 96500 C/mol
Xác định đúng số electron n trong từng phản ứng
Luôn đổi thời gian sang giây trước khi tính toán
Phân biệt rõ catot (-) và anot (+):
- Catot: khử, nhận e
- Anot: oxi hóa, nhường e
Nhớ tỉ lệ điện phân nước: $V_{H_2}:V_{O_2} = 2:1$

Cô Trần Thị Bình
(Người kiểm duyệt, ra đề)
Chức vụ: Tổ trưởng chuyên môn Tổ Lý – Hóa – Sinh tại Edus
Trình độ: Cử nhân Sư phạm Vật lý, Hoá Học, Bằng Thạc sĩ, Chức danh nghề nghiệp Giáo viên THPT – Hạng II, Tin học ứng dụng cơ bản, Ngoại ngữ B1
Kinh nghiệm: 12+ năm kinh nghiệm tại Trường THPT Gia Định
